![]()
1
Grundsätze der Validierung in der Analytik und im Prüfwesen1
1.1 Einführung
Validierung bedeutet, auf die Frage zu antworten, ob ein Prüfverfahren, eine analytische Methode oder eine Meß-/Prüfeinrichtung für die Erfüllung einer ganz bestimmten Aufgabe geeignet ist
Um auf diese Frage antworten zu können, muß man dreierlei wissen:
– Wie lautet die bestimmte Aufgabe, die gelöst werden soll?
– Durch welche charakteristischen Leistungsmerkmale kann das für die Lösung der Aufgabe vorgesehene Verfahren auf Eignung getestet werden?
– Wie lauten die experimentell ermittelten Werte der ausgesuchten Merkmale?
Somit können die von der Aufgabenstellung her geforderten Fähigkeiten des Verfahrens/der Methode/der Prüfeinrichtung mit den tatsächlichen Leistungsmerkmalen verglichen werden und die eigentliche Validierungsfrage auf Eignung beantwortet werden
Stellt der Validierer anschließend auch noch formal fest, daß das vorgesehene Verfahren tatsächlich imstande ist, die gestellten Forderungen zu erfüllen, so sind alle Schritte der Validierungsprozedur normgerecht ausgeführt
Bemerkung: Der Einfachheit halber wird im folgenden nicht von dem Verfahren/der Methode/der Prüfeinrichtung sondern stellvertretend von der Methode die Rede sein
Zusammenfassend bedeutet das Gesagte folgendes:
Methodenvalidierung bedeutet, die Absicht des Auftraggebers zu kennen und anschließend herauszufinden, ob eine Methode für den vorgesehenen Verwendungszweck geeignet ist
Die Validierung betrifft immer zwei Parteien:
1. Der Aufgabensteller
Zunächst muß jemand da sein, der eine Aufgabe stellt. Die zu lösende Aufgabe kann sich auch aus den Interessen der Öffentlichkeit ergeben oder sie kann aus den Forderungen von Gesetzen, Verordnungen oder normativen Dokumenten resultieren. Es ist letztlich belanglos, wer die Aufgabe formuliert; dies kann ein externer oder interner Kunde sein, ebenso gut kann das Labor selbst jene Forderungen formulieren, welche die Methode erfüllen muß.
2. Der Aufgabenlöser
Der Aufgabensteller benötigt jemanden, der für ihn die Aufgabe löst, also ein Labor. Um eine vollständige Validierung durchzuführen, muß das beauftragte Labor nun folgendes tun:
– Es muß die Aufgabe, und allenfalls auch das Problem des Auftraggebers, verstehen und
– es muß abklären, ob die für die Aufgabenlösung vorgesehene Methode imstande ist, Ergebnisse zu liefern, die für die Aufgabenlösung nützlich sein werden; oder mit anderen Worten, ob sie für den vorgesehenen Verwendungszweck geeignet ist. Gegebenenfalls muß es eine Alternativmethode vorschlagen.
– Es wird dem Aufgabensteller mitteilen, daß es im Stand ist, die gestellte Aufgabe zu lösen.
– Im Zweifelsfall wird es die Eignung der Methode zu überprüfen haben, d. h. es hat zu prüfen, ob die ermittelten Zahlenwerte der Merkmale von einer leistungsfähigen, sprich von einer für die konkrete Aufgabenstellung geeigneten Methode zeugen.
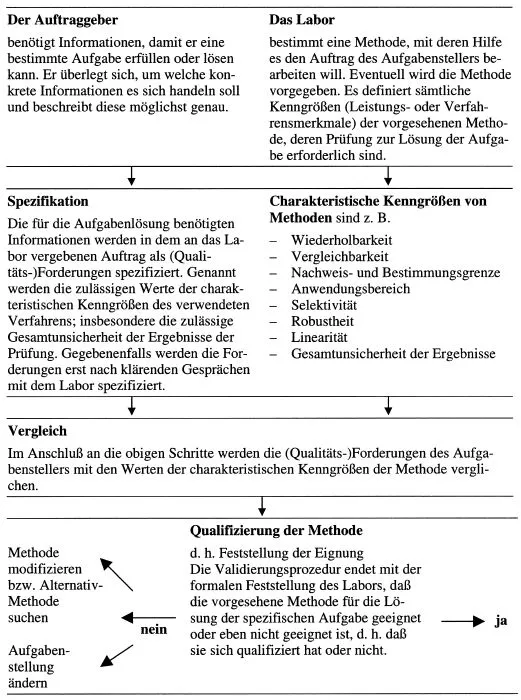
Die Validierungsprozedur läßt sich am besten in einem Ablaufschema darstellen. Dieses zeigt, daß sowohl der Auftraggeber in seiner Funktion als Aufgabensteller, wie auch das Labor als Auftragnehmer und Aufgabenlöser bei der Validierung eine wichtige Rolle zu übernehmen haben, siehe Tab. 1-1. In der Praxis kommt es oft vor, daß das Labor die Fragestellung des Kunden so gut versteht, daß es sehr wohl im Stand ist, stellvertretend für den Kunden selbst die geplante Vorgehensweise zu definieren und dann mit ihm abzusprechen
Tab. 1-1 Ablauf einer Validierungsprozedur (allgemeines Schema)
1.2 Definition, Erläuterung und Kommentierung von Begriffen der Qualitätssicherung
Trotz klarer Vorstellungen bezüglich des Begriffs Validierung, wie sie in der obigen Einführung dargelegt wurde, und trotz vieler Diskussionen darüber, besteht bis heute immer noch eine gewisse Verwirrung bezüglich verwandter Begriffe wie Validierung, Zertifizierung, Charakterisierung, Verifizierung und Qualifizierung. Diese Konfusion hat weit mehr als nur linguistische oder semantische Bedeutung. Die Autoren plädieren keinesfalls für die Beibehaltung oder gar zwingende Verwendung all dieser Begriffe. Es zeigt sich jedoch, daß dadurch eher Probleme auftreten als daß deren Verwendung der Klärung dient. Leider existieren sie und werden in der Praxis immer noch in eigenwilliger und zugleich arbiträrer Weise verwendet, was die Verständigung zwischen den betroffenen Parteien nicht gerade erleichtert: Wollte man die heutige Situation in der Analytik charakterisieren, so dürfte folgendes – außer in der Pharmaindustrie, wo der Validierungsgedanke sehr weit fortgeschritten und strukturiert ist – wohl häufig zutreffen:
Viele der Betroffenen wissen heute ganz genau, was für sie selbst Validierung, Verifizierung und Qualifizierung bedeutet; nur meinen leider andere Leute unter diesen Begriffen nicht genau das gleiche und manchmal sogar etwas recht Unterschiedliches
Oft werden auch die klaren Auslegungen der Begriffe Validierung, Verifizierung und Qualifizierung aus Regelwerken wie ISO 8402:1994 und DIN EN ISO 17025:1998, siehe unten, ignoriert
Ein Beispiel: In dem Dokument der ILAC „Guideline for validating test methods“ 3rd draft of ILAC WG6: 1994-05-13 wird der Begriff Validierung, wie in der ISO 8402 definiert, nicht beachtet und für den eigenen Gebrauch eine Umschreibung verwendet, die gemäß der Norm auf den Begriff Verifizierung zutrifft
Was notwendig ist, ist einerseits eine Verständigung unter den Betroffenen bezüglich der Begrifflichkeiten, andererseits sollte eine pragmatische, dem Laboralltag dienende Auslegung angestrebt werden. Diesem Zweck sollen die nachfolgenden Definitionen und Erläuterungen dienen
1.2.1 Validierung
Mit Validierung verbindet jeder Analytiker die Überprüfung einer Methode auf Brauchbarkeit. Der Begriff Validierung taucht offiziell erst in den 70er Jahren auf:
| 1975 in Europa: | Richtlinie des Rates 75/318 (EWG) |
| 1978 in den USA: | FDA, im Zusammenhang mit der Produktion von Arzneimittel |
Nachfolgend eine Auswahl von Definitionen aus der Literatur
– Dertinger, Gänshirt, Steinigen in „GAP Praxisgerechtes Arbeiten in pharmazeutisch-analytischen Laboratorien“, Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart 1984: „Validierung ist der Nachweis und die Dokumentation der Zuverlässigkeit einer Methode.“
– H. Bosshardt, F. Schorderet, H. Feltkamp, P. Fuchs und H. Sucker, Pharmazeutische Qualitätskontrolle, Georg Thieme Verlag, Stuttgart 1983: „Unter Validierung versteht man die Gesamtheit aller sich über Planung, Ausführung und Dokumentation erstreckenden Maßnahmen, die die Gültigkeit einer analytischen Methode beweisen. Der Prüfaufwand richtet sich nach der Methodik, der Apparatur und den Anforderungen an die Güte des Resultats.“
– Chapmann, 1985: „Validierung heißt nichts Anderes als gesunder Menschenverstand – gut organisiert und gut dokumentiert.“
– FDA, 1986 (im Hinblick auf Produktion): „Validierung ist der dokumentierte Nachweis, daß ein bestimmter Prozeß mit einem hohen Grad an Sicherheit kontinuierlich ein Produkt erzeugt, das vorher definierte Spezifikationen und Qualitätsmerkmale erfüllt.“
– Inspectorate for Health Protection, Food Inspection Service, Niederland: „Validierung ist die Prozedur, die sicherstellt, daß eine Testmethode so zuverlässig ist wie möglich. Dieser Prozeß besteht aus einem (Test)Programm, das zur Beantwortung folgender Fragen führt: „Wie richtig ist es ?“ und „Wie präzise ist die Methode in den Händen des Routineanwenders?“
– Römpp Chemie Lexikon, 1992 (ebenfalls auf die Produktion bezogen): „Validierung umfaßt (nach dem verbindlichen Code von „Good Validation Practices“ in der Pharmazeutischen Industrie, Anm. der Autoren) die systematische Überprüfung der wesentlichen Arbeitsschritte und Einrichtungen in Entwicklung und Produktion einschließlich der Kontrolle von pharmazeutischen Produkten mit dem Ziel, sicherzustellen, daß die hergestellten Produkte bei Innehaltung der festgelegten Produktions- und Kontrollverfahren zuverlässig und reproduzierbar in der gewünschten Qualität hergestellt werden können.“
– USP<1225>: „Validierung ist der Prozeß, durch den mittels Laborexperimenten gezeigt wird, daß die Leistungsmerkmale (Charakteristika) einer Methode den Forderungen für eine beabsichtigte Anwendung genügen.“
– ICH, 1995: „Das Ziel bei der Validierung einer analytischen Methode ist zu zeigen, daß sie für den beabsichtigten Zweck geeignet ist.“
– ISO 8402, 1994 § 2.18. Diese Definition kann als allgemein verbindlich angesehen werden (siehe weiter unten bei DIN ISO IEC 17025): „Bestätigen aufgrund einer Untersuchung und durch Bereitstellung eines objektiven Nachweises, daß die besonderen Forderungen für einen speziellen beabsichtigten Gebrauch erfüllt worden sind.“ (objektiver Nachweis: nachweisbare Informationen basierend auf Tatsachen, die man durch Beobachtung, Messung, einen Test oder auf eine andere Art und Weise (other means!) erhält)
Jüngst wurde ein Schritt vollzogen, der Beachtung verdient: Aus dem ISO Guide 25 und der EN 45001 (1989) wird eine neue internationale Norm, die ISO 17025 (Allgmeine Anforderungen an die Kompetenz von Prüf- und Kalibrierlaboratorien). Zur Zeit liegt der Norm-Entwurf DIN ISO/IEC 17025:1998-10 als Ersatz für den Entwurf DIN EN 45001:1997-06 vor und zwar als DIS 17025 (DIS für Draft International Standard). Mit der neuen Norm wird dem Vorschlag der DIN Rechnung getragen, eine Gleichstellung der Wertigkeit des ISO-Standards mit der europäischen Norm EN45001:1997-06 zu erreichen
Der Entwurf DIN ISO/IEC 17025:1998-10 lag bis November 1998 zur Kommentierung frei und er soll bis Ende 1999 den Status eines F-DIS (Final Draft International Standard) haben. Diese internationale Norm in spe (zu beziehen bei: Beuth Verlag GmbH, 10772 Berlin) kann als ein wichtiger Bezugspunkt für analytische Laboratorien (Prüf- und Kalibrierlaboratorien) angesehen werden. Daher lohnt es sich, die Textpassagen des Entwurfes zu „Validierung von Verfahren“ im Wortlaut zu verfolgen:
„Die Validierung ist die Bestätigung durch Untersuchung und Bereitstellung eines Nachweises, daß die besonderen Anforderungen für einen speziellen beabsichtigten Gebrauch erfüllt werden
Das Laboratorium muß nicht genormte, selbst entwickelte Verfahren, genormte Verfahren, die außerhalb ihres vorgesehenen Anwendungsbereiches angewendet werden und Erweiterungen von genormten Verfahren validieren, um zu bestätigen, daß die Verfahren für den beabsichtigten Gebrauch geeignet sind. Die Validierung muß in dem Umfang durchgeführt werden, der zur Erfüllung der Erfordernisse der beabsichtigten Anwendung oder des betreffenden Anwendungsgebiets notwendig ist. Das Laboratorium muß die erhaltenen Ergebnisse und das für die Validierung verwendete Verfahren aufzeichnen und festlegen, ob das Verfahren für den beabsichtigten Gebrauch geeignet ist
Der Bereich und die Genauigkeit der mit validierten Verfahren erreichbaren Werte (z. B. Ergebnisunsicherheit, Nachweisgrenze, Selektivität des Verfahrens, Linearität, Wiederholgrenze und/oder Vergleichsgrenze, Robustheit gegen äußere Einflüsse und/oder Querempflindlichkeit gegenüber Beeinflussungen durch die von der Matrix der Probe/des Prüfgegenstandes), wie sie für die beabsichtigte Anwendung beurteilt werden, müssen den Erfordernissen des Kunden entsprechen
Anmerkung 1: Validierung schließt die Beschreibung der Anforderungen, die Bestimmung der Verfahrensmerkmale, den Vergleich der Anforderungen mit den Werten der Verfahrensmerkmale und eine Aussage zu ihrer Gültigkeit ein
Anmerkung 2: Zur Bestimmung der Verfahrensmerkmale sollte eine der folgenden Methoden oder eine Kombination davon verwendet werden: Kalibrierung mit Referenznormalen oder Referenzmaterialien, Vergleich zwischen Ergebnissen, die mit anderen Verfahren erzielt wurden, Vergleiche zwischen Laboratorien, systematische Beurteilung der Faktoren, die das Ergebnis beeinflussen, Beurteilung der Ergebnisunsicherheit auf der Grundlage wissenschaftlichen Verstehens der theoretischen Grundlagen des Verfahrens und praktischer Erfahrung
Anmerkung 3: Bei weiterer Entwicklung des Verfahrens sind regelmäßige Prüfungen erforderlich, die sicherstellen sollen, daß die Erfordernisse des Kunden noch immer erfüllt werden. Änderungen der Anforderungen, die Modifizierungen des Entwicklungsprogramms erfordern, müssen geprüft und genehmigt werden
Anmerkung 4: Bei der Validierung sind immer die Kosten, Risiken und technischen Möglichkeiten abzuwägen.“
Kommentare zum Entwurf
– Die für diese Textlänge relativ häufige Anzahl von Passagen zum Thema zielgerichtete Validierung
„ … für einen speziellen beabsichtigten Gebrauch …“
„ … müssen den Erfordernissen des Kunden entsprechen …“
„ … daß die Erfordernisse des Kunden noch immer erfüllt werden …“
zeugen von einer Praxisnähe und einer wesentlich stärkeren Kundenorientierung im Vergleich zu älteren Texten. Das ist eine erfreuliche Entwicklung. Es gilt jetzt diesen Geist im Alltag zu leben
–Folgende, eindeutige Aussage schafft Klarheit: Genormte Verfahren müssen nicht validiert werden.
Ob allerdings stets darauf verzichtet werden kann, wenn es tatsächlich um Wahrheitsfindung geht, sollte individuell entschieden werden
– Die Schritte einer Validierung sollten folgende sein:
- Beschreibung der Anforderungen
- Findung und Bestimmung von aussagefähigen Verfahrensmerkmalen
- Vergleich der Anforderungen mit den erhaltenen Werten der Verfahrensmerkmale
- Ja/Nein-Aussage über die Eignung der Methode für den vorgesehenen Gebrauch.
Die Anforderung, daß das Laboratorium die Ergebnisse und verwendeten Verfahren aufzeichnen muß, bekräftigt das tatsächliche Ziel bei einer Validierung: Der Validierer muß Aussagen machen und nicht lediglich Zahlen/Daten erzeugen
Dem erfahrenen Leser fällt beim Aufzählen von erreichbaren Werten zweierlei auf:
– Die klassischen, wichtigen Elemente „Richtigkeit“ und „Präzision“ fehlen, dafür taucht „Ergebnisunsicherheit“ auf. Hier wird die Auffassung der Verfasser offenkundig: Es ist ein Plädoyer für die Ermittlung bzw. Schätzung der „Ergebnisunsicherheit“ als übergeordnetes Merkmal, das geeignet ist, die tatsächliche Streuung von Werten (zufällige Abweichungen = Präzision, systematische Abweichungen = Richtigkeit) zu beschreiben und einen realen Vertrauensbereich anzugeben (siehe Ausführungen weiter unten und in Abschnitt 3.4.3). Systematische und zufällige Fehler sind nur Beiträge zur Gesamtunsicherheit der Ergebnisse. Eine Unterscheidung in systematischen und zufälligen Fehlern ist nicht notwendig.
– Es wird die „Nachweisgrenze“, nicht jedoch die „Bestimmungsgrenze“ erwähnt. Auf Anfrage von S. Kromidas wurde folgendes als plausibler Grund für den Verzicht genannt: Ein Nicht-Naturwissenschaftler kann mit dem Begriff Nachweisgrenze umgehen, eine klare Abgrenzung zur Bestimmungsgrenze ist nicht trivial. Dies wurde in einer Reihe von juristischen Auseinandersetzungen deutlich.
Der Verzicht auf „Bestimmungsgrenze“ kann fachlich wie folgt begründet werden: Bestimmungsgrenze ist letzten Endes nichts mehr als eine erweiterte Meßunsicherhheit. Deswegen ist – übrigens in Übereinstimmung mit ISO 11843–1, siehe Abschnitt 3.2.1 die Benutzung des Begriffes „Bestimmungsgrenze“ expressis verbis nicht notwendig
Die Ausführungen im Entwurf von ISO 17025 kommen der Praxis sehr nahe und sind daher praktikabel. Ein wichtiger Punkt allerdings, der nicht erwähnt wird, ist die Methodenstabilität. Das ist die Abhängigkeit eines Ergebnisses von der Zeit bei Anwendung der konkreten Methode unter realen Bedingungen. Es geht um die Streuung von Ergebnissen, wenn alle relevanten Faktoren im realen Routinealltag wirksam sind und nicht nur während der relativ kurzen Zeit der Validierungstätigkeit
Die Praxis zeigt immer wieder, daß die Nichtbeachtung dieses Aspektes zu unnötigen Differenzen zwischen Validierer und Routineanwender und zu erheblichen Kosten führt
Über eine Stellungnahme von S. Kromidas beim nationalen Normungsausschuß mit dem Hinweis, bei der Endfassung der ISO 17025 die Methodenstabilität als Verfahrensmerkmal zu erwähnen, wird noch entschieden
Vor dem Versuch einer Zusammenfassung werden sieben Validierungsthesen für die Analytik vorgestellt. Diese lehnen sich an die sieben Validierungsthesen für die Herstellpraxis nach Sucker [1] an:
– Validierung ist ein Arbeitsinstrument zur Qualitätssicherung neben anderen wie z. B. SPC (Statistische Prozeßkontrolle).
– Validierung ist produkt- und zweckspezifisch auszuführen. Die Verantwortung über Ausmaß und Art liegt beim Analytiker.
– Validierung heißt, das Notwendige zu tun, aber eine Eskalation zu vermeiden. Alle kritischen Kenngrößen der Methode müssen validiert werden, aber nicht wähl- und kritiklos alle.
– Methodenvalidierung beginnt am besten beim Endergebnis und geht im Analysenablauf bis zum ersten Schritt zurück.
– Validierung kann nicht durch Abhaken von Resultaten mittels Checkliste erfolgen.
– Eine fehlerfreie Analytik („wahrer Wert“) gibt es nicht. Nach Möglichkeit sind die statistische Relevanz und damit die Meßunsicherheit zu ermitteln.
– Für validierte Methoden sind Art und Häufigkeit der notwendigen Kontrollen festzulegen mit dem Ziel, den Gesamtanalysenaufwand zu minimieren, aber dennoch die erforderliche Ergebnissicherheit zu erzielen.
Resumé und Kommentar
Die Definition des Entwurfes der ISO 17025: 1998 läßt dem Analytiker nahezu alle Freiheiten, wenn er nur erstens weiß, was er will („besonderen Forderungen für einen speziellen, beabsichtigten Gebrauch“) und zweitens in der Lage ist, eine fachgerechte Durchführung zu garantieren, d. h. wenn er einen „objektiven Nachweis“ liefert
Bemerkung: Im ISO Entwurf 17025 fehlt im Vergl...