![]()
1
Metalle
Andrea Hartwig
1.1 Allgemeine Aspekte
Metallionen und Metallverbindungen sind ubiquitär in der Umwelt vorhanden. Viele von ihnen, darunter Calcium, Magnesium, Zink, Cobalt, Nickel, Mangan und Eisen, sind essentielle Bestandteile von biologischen Systemen. Sie vermitteln den Sauerstofftransport und -metabolismus, katalysieren Elektronenübertragungsreaktionen, sind an der Signaltransduktion beteiligt und stabilisieren die Struktur von Makromolekülen. Zudem vermitteln sie aber auch das Zusammenwirken der Makromoleküle untereinander, wie beispielsweise Zink in sogenannten Zinkfingerstrukturen, die als häufiges Motiv bei DNA-bindenden Proteinen nachgewiesen wurden. Für andere Metallverbindungen, wie solche von Blei, Arsen, Cadmium und Quecksilber, sind bislang keine essentiellen Funktionen beschrieben worden.
Aus toxikologischer Sicht weisen Metalle und Metallverbindungen einige Besonderheiten auf. So sind toxische und sogar kanzerogene Wirkungen keineswegs auf nicht essentielle Metalle beschränkt, sondern werden auch bei essentiellen Elementen beobachtet. Die oftmals enge Verknüpfung zwischen essentieller und toxischer Wirkung wird besonders bei Übergangsmetallen wie Eisen und Kupfer deutlich. Während eine ihrer essentiellen biologischen Funktionen darin besteht, Ein-Elektronen-Übergänge zu katalysieren, kann genau diese Fähigkeit der Übergangsmetallionen zu toxischen Reaktionen führen, indem die Generierung reaktiver Sauerstoffspezies katalysiert wird, die in der Folge zelluläre Makromoleküle schädigen können. Hier wird deutlich, dass eine genaue Regulation der Metallionenkonzentrationen in Geweben und Zellen nötig ist, um toxische Effekte zu verhindern; dies wird beispielsweise bei Eisen durch eine strikte Kontrolle der Aufnahme und der intrazellulären Speicherung erreicht. Toxische Wirkungen kommen dann zustande, wenn diese homöostatische Kontrolle entweder durch zu hohe Konzentrationen oder durch unphysiologische Aufnahmewege außer Kraft gesetzt wird. So wird die Resorption von essentiellen Elementen aus der Nahrung durch den Gastrointestinaltrakt stark reguliert; diese Kontrolle wird aber umgangen, wenn die Exposition über die Haut oder die Lunge erfolgt. Ein weiteres Prinzip der toxischen Wirkung von Metallverbindungen besteht in der Kompetition toxischer Metallionen mit essentiellen Metallionen. Diese Wechselwirkungen finden auf der Ebene der Aufnahme und der intrazellulären Funktionen statt; potenzielle Folgen sind eine verminderte Bioverfügbarkeit essentieller Metallionen, Störungen der Signaltransduktion sowie der Struktur und Funktion von Makromolekülen. Schließlich muss noch berücksichtigt werden, dass die toxische Wirkung nicht nur von Metall zu Metall stark variiert, sondern auch erheblich von der jeweiligen Verbindungsform bestimmt wird. Wesentliche Einflussfaktoren sind hier die Oxidationsstufe und die Löslichkeit, die wiederum die Aufnahme und damit die Bioverfügbarkeit von Metallverbindungen modifizieren können.
1.1.1 Toxische Wirkungen von Metallverbindungen unter besonderer Berücksichtigung der Kanzerogenität
Die meisten Erkenntnisse über toxische Wirkungen von Metallverbindungen beim Menschen wurden in epidemiologischen Studien mit Personen gewonnen, die beruflich exponiert waren bzw. sind. Schwere akute Gesundheitsstörungen durch Metallbelastungen in der allgemeinen Umwelt sind demgegenüber heutzutage selten, aber nicht ausgeschlossen. Hier sind insbesondere Cadmium, Blei, Quecksilber und Arsen von Belang. So wurde das Auftreten der sog. „Itai-Itai“-Krankheit in Japan mit dem Verzehr von Cadmium-kontaminiertem Reis und Wasser in Verbindung gebracht. Quecksilbervergiftungen in der allgemeinen Bevölkerung wurden in Japan und im Irak beobachtet. Gründe hierfür waren im ersten Fall der Konsum von kontaminiertem Fisch aus Quecksilber-verseuchten Gewässern und im zweiten Fall die Behandlung von Saatgut mit Quecksilber-haltigen Fungiziden. Bleivergiftungen wurden hauptsächlich bei Kindern durch das Verschlucken von bleihaltigen Farben hervorgerufen. Auch im Fall von Arsen sind Umweltbelastungen von Bedeutung. Hier können insbesondere die Belastung von Böden und Trinkwasser sowie der Verzehr arsenbelasteter Nahrungsmittel zu subakuten oder chronischen Gesundheitsstörungen führen.
Während die Symptome akuter oder subakuter Metallvergiftungen gut bekannt sind und heutzutage nur noch selten auftreten, gewinnt die Aufklärung von chronischen Gesundheitsschäden, die bei länger andauernder Exposition gegenüber vergleichsweise geringen Konzentrationen toxischer Metallverbindungen auftreten, an Bedeutung. Hierzu gehören beispielsweise Schädigungen des Zentralnervensystems durch Blei, Mangan und Quecksilber sowie Schädigungen des Immunsystems. Besonderes Interesse gilt aber der Frage nach einer potenziell Krebs erzeugenden Wirkung von Metallverbindungen. So wurden u. a. Chromate sowie Nickel-, Cadmium- und Arsenverbindungen in epidemiologischen Studien als kanzerogen identifiziert. Bei Verbindungen von Blei und Cobalt ergaben epidemiologische Untersuchungen – hauptsächlich aufgrund von Mischexpositionen – widersprüchliche Ergebnisse; hier traten jedoch vermehrt Tumore in Langzeit-Kanzerogenitätstests mit Versuchstieren auf.
Die Bewertungen der einzelnen Metalle und ihrer Verbindungen bezüglich ihrer Kanzerogenität für den Menschen durch die „International Agency for Research on Cancer“ (IARC), Lyon, und die Senatskommission der Deutschen Forschungsgemeinschaft zur gesundheitlichen Bewertung von Arbeitsstoffen (MAK-Kommission) sind in Tabelle 1.1 zusammengefasst.
Tab. 1.1 Klassifikationen ausgewählter kanzerogener Metalle und ihrer Verbindungen.
| Antimon und seine Verbindungen | Ø | 2 (ausgenommen SbH3) |
| Antimontrioxide (Sb2O3) | 2B | 2 |
| Antimontrisulfid (Sb2S3) | 3 | 2 |
| Arsen und seine Verbindungen | 1 | 1 |
| Beryllium und seine Verbindungen | 1 | 1 |
| Blei (Metall) | Ø | 2 |
| Bleiverbindungen | 2A | 2 |
| Butylzinnverbindungen | Ø | 4 |
| Cadmium und seine Verbindungen | 1 | 1 |
| Chrom (Metall) | 3 | Ø |
| Chrom(VI)-Verbindungen | 1 | 2 (außer ZnCrO4: Kat. 1) |
| Chrom(III)-Verbindungen | 3 | Ø |
| Cobalt und seine Verbindungen | 2B | 2 |
| Hartmetalle (Wolframcarbid) | 2A | 1 |
| Nickel (Metall) | 2B | 1 |
| Nickelverbindungen | 1 | 1 |
| Quecksilber und seine Verbindungen | 2B | 3B |
| Rhodium | Ø | 3B |
| Selen und seine Verbindungen | 3 | 3B |
| Vanadium und seine Verbindungen | Ø | 2 |
| Vanadiumpentoxid (V2O5) | 2B | 2 |
1.1.2 Wirkungsmechanismen kanzerogener Metallverbindungen
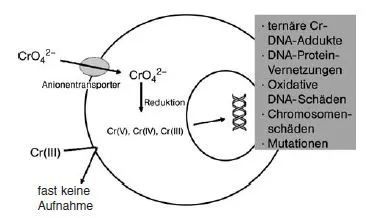
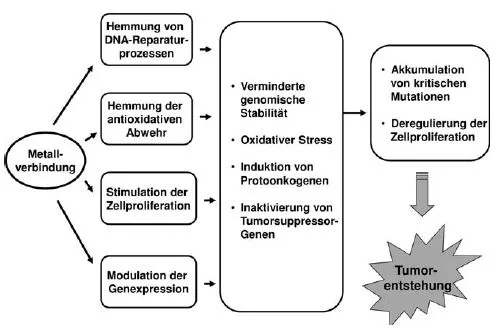
Bei der Kanzerogenese von Metallverbindungen ist in den meisten Fällen die direkte Wechselwirkung von Metallionen mit DNA-Bestandteilen von untergeordneter Bedeutung. Eine Ausnahme bilden Chromate, die intrazellulär zu Chrom(III) reduziert werden und potenziell mutagene ternäre Cr-DNA-Addukte bilden, an denen auch das Reduktionsmittel wie z. B. Ascorbat beteiligt ist (siehe Abb. 1.1). Für die meisten anderen Metallverbindungen sind eher indirekte Mechanismen postuliert worden: die vermehrte Bildung reaktiver Sauerstoffspezies (ROS), eine Inaktivierung von DNA-Reparaturprozessen, Veränderungen der Genexpression sowie Wechselwirkungen mit Signalübertragungsprozessen (siehe Abb. 1.2).
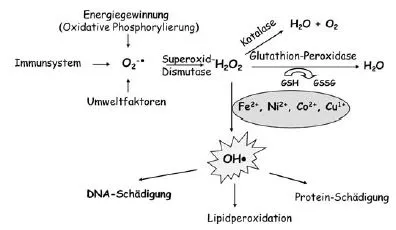
So wurden für einige Metallverbindungen oxidative DNA-Schäden in zellulären Testsystemen nachgewiesen, die jedoch durch indirekte Mechanismen hervorgerufen werden (siehe Abb. 1.3). Beispiele sind die Katalyse Fenton-ähnlicher Reaktionen mit H2O2 durch Übergangsmetallionen und damit die Generierung von sehr reaktiven Hydroxyl-Radikalen sowie die Inaktivierung von Schutzenzymen gegenüber reaktiven Sauerstoffspezies (ROS). Ein gemeinsamer Mechanismus für die meisten Metallverbindungen besteht darüber hinaus in der Beeinflussung von DNA-Reparatursystemen; hier haben Arbeiten der letzten Jahre erhebliche Fortschritte bezüglich der molekularen Angriffspunkte erbracht. So wird die DNA permanent durch endogene Stoffwechselprozesse und durch eine Vielzahl von Umweltfaktoren geschädigt. Zur Vermeidung von Mutationen, also permanente Veränderungen der genetischen Information, verfügt die Zelle über ein umfangreiches Schutzsystem, von denen DNA-Reparaturprozesse eine wichtige Rolle spielen. Metallverbindungen, wie solche von Nickel, Cadmium, Arsen, Cobalt und Antimon, hemmen DNA-Reparaturprozesse in teilweise sehr niedrigen Konzentrationen, sodass wichtige Schutzmechanismen gegenüber Umweltmutagenen, aber auch gegenüber DNA-Schäden durch reaktive Sauerstoffspezies in ihrer Funktion herabgesetzt werden. Dies führt zu Wirkungsverstärkungen in Kombination mit anderen mutagenen und kanzerogenen Substanzen. Als molekulare Angriffspunkte wurden u.a. Zink-bindende Strukturen in DNA-Reparatur- und Tumorsuppressorproteinen identifiziert. Darüber hinaus wurden für einige Metalle Veränderungen im DNA-Methylierungsmuster beobachtet, die zu veränderten Genexpressionsmustern führen können; besonders kritisch im Rahmen der Krebsentstehung ist dabei die Aktivierung von Wachstumsgenen (Onkogenen) oder die Inaktivierung von Tumorsuppressorgenen (zusammengefasst in [1, 2]).
1.1.3 Bioverfügbarkeit als zentraler Aspekt der speziesabhängigen Wirkungen
Ein zentraler Aspekt der Metalltoxikologie ist die Frage der Bewertung der unterschiedlichen Metallspezies. Ein Beispiel ist Chrom: Während Chrom(VI)-Verbindungen kanzerogen sind, ist dies für Chrom(III)-Verbindungen nicht belegt. Dies kann auf Unterschiede in der Bioverfügbarkeit zurückgeführt werden. Wasserlösliche Chrom(VI)-Verbindungen werden über den Anionentransporter aufgenommen, intrazellulär über verschiedene Zwischenschritte zu Chrom(III) reduziert und führen u. a. zu DNA-Schädigungen und Mutationen. Für lösliche Chrom(III)-Verbindungen hingegen ist die Zellmembran nahezu impermeabel (siehe oben ).
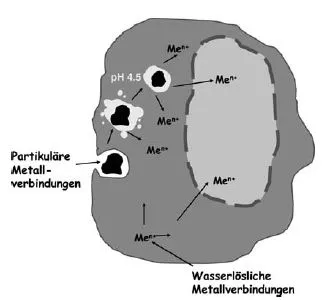
Für andere Metalle und ihre Verbindungen stellt sich die Frage der toxikologischen Bewertung von schwer wasserlöslichen, partikulären im Vergleich zu gut wasserlöslichen Verbindungen. Besonders gut wurde dies am Beispiel Nickel untersucht. Sowohl wasserlösliche als auch partikuläre Nickelverbindungen sind kanzerogen beim Menschen; im Tierversuch gehören Verbindungen mittlerer Löslichkeit und mittlerer Toxizität wie Nickelsulfid (NiS) und Nickelsubsulfid (aNi3S2) zu den stärksten bekannten Kanzerogenen überhaupt. Entscheidend sind vor allem die Löslichkeit in extrazellulären Flüssigkeiten, die Aufnahme der Verbindungen in die Zellen der Zielorgane, sowie die anschließende intrazelluläre Freisetzung von Nickelionen als das ultimal schädigende Agens.
Lösliche Nickelverbindungen werden über Ionenkanäle in die Zellen aufgenommen. Weitgehend wasserunlösliche, kristalline Partikel werden phagozytiert und gelangen so in die Lysosomen und in die Nähe des Zellkerns; dort lösen sie sich aufgrund des sauren pH-Wertes in den Lysosomen allmählich auf und setzen Nickelionen frei (siehe Abb. 1.4). Insgesamt zeigen Versuche in Zellkulturen eine vergleichbare Verteilung von Nickelionen im Zytoplasma und im Zellkern für wasserlösliche und partikuläre Nickelverbindungen. Dies gilt auch für die biologischen Effekte. Sowohl Nickelchlorid als auch partikuläres Nickeloxid bewirken eine deutliche, in ihrem Ausmaß vergleichbare DNA-Schädigung und DNA-Reparatur-Hemmung in Zellkultursystemen. Das höhere kanzerogene Potenzial von partikulärem Nickeloxid und -subsulfid im Tierversuch ist daher wahrscheinlich eher auf die wesentlich längere Retentionszeit in vivo zurückzuführen und nicht auf unterschiedliche Schädigungsmechanismen auf zellulärer Ebene. Somit sind die Wirkungen der unterschiedlichen Spezies qualitativ gleich und durch Nickelionen bedingt; entscheidende Faktoren für quantitative Unterschiede sind die Bioverfügbarkeit und die biologische Halbwertszeit.
1.2 Toxikologie ausgewählter Metallverbindungen
1.2.1 Aluminium
1.2.1.1 Vorkommen und relevante Expositionen
Aluminium ist das dritthäufigste Element der Erdkruste und kommt als natürlicher Bestandteil insbesondere im Trinkwasser und in pflanzlichen Lebensmitteln vor. Zu nennen sind insbesondere Gemüse, Obst sowie Tee und Gewürze. Weitere relevante Expositionen resultieren aus Aluminium-haltigen Zusatzstoffen in z. B. Back- und Süßwaren sowie über Aluminium-haltige Lebensmittelverpackungen und Aluminium-haltiges Kochgeschirr. Während für die meisten Lebensmittel vergleichsweise niedrige Aluminiumeinträge über Bedarfsgegenstände resultieren, ist dies insbesondere für die Aufbewahrung von sauren Lebensmitteln von Bedeutung: hier können durch die Verwendung von Aluminiumfolien und -gefäßen vergleichsweise hohe Aluminiumwerte auftreten.
1.2.1.2 Toxische Wirkungen
Nach hoher inhalativer Exposition gegenüber Aluminium-haltigen Stäuben und Schweißrauchen wurden Lungenfibrosen und obstruktive Atemwegserkrankungen beobachtet. Toxische Wirkungen des Aluminiums umfassen darüber hinaus Interaktionen mit dem Phosphat- und Calciumstoffwechsel mit der Folge der Reduktion der Knochenfestigkeit, neurotoxischer Wirkungen sowie embryotoxischer Effekte im Tierversuch. Da die Bioverfügbarkeit von Aluminium nach oraler Aufnahme maximal 1% beträgt, manifestierten sich toxische Effekte bei beruflich nicht exponierten Personen hauptsächlich bei Dialysepatienten, die gegenüber hohen Konzentrationen von Aluminium im Dialysewasser, durch die therapeutische Gabe von Aluminiumhydroxid und/oder nach der Einnahme von Antacida (> 1000 mg Al Tag−1) exponiert waren. Hier traten Mineralisierungsstörungen der Knochen, Anämie und Hirnschädigungen auf (Dialyse-Enzephalopathie). Ein vielfach postulierter Zusammenhang zwischen Aluminiumexposition und dem Auftreten von Alzheimer-Erkrankungen konnte auch bei hochexponierten Personen nicht manifestiert werden, da sich die neuropathologischen Veränderungen deutlich unterscheiden. Dennoch gibt es zahlreiche Hinweise darauf, dass Aluminium die Blut-Hirnschranke passieren kann und in höheren Konzentrationen neurotoxisch wirkt; die genaue Ursache ist unklar, diskutierte Mechanismen sind oxidativer Stress, Entzündungsprozesse oder die Hemmung des Abbaus von Amyloidpeptiden.
1.2.1.3 Grenzwerte und Einstufungen
Vom Gemeinsamen Expertengremium für Lebensmittelzusatzstoffe der Welternährungsorganisation (FAO) und der WHO (JECFA) und dem wissenschaftlichen Lebensmittelausschuss der EU-Kommission (SCF) wurde 1989 ein vorläufiger, tolerierbarer wöchentlicher Aufnahmewert (PTWI „Provisional Tolerable Weekly Intake“) in Höhe von 7 mg kg−1 Körpergewicht für die Gesamtaufnahme von Aluminium aus Lebensmitteln, einschließlich Aluminiumsalzen in Lebensmittelzusatzstoffen, abgeleitet. Dieser PTWI-Wert wurde 2006 von der JECFA auf 1 mg kg−1 Körpergewicht für die Gesamtaufnahme von Aluminium aus Lebensmitteln gesenkt. Das Komitee kam zu dem Schluss, dass Aluminium die Fortpflanzung und das sich entwickelnde Nervensystem bereits in niedrigeren Dosen beeinträchtigen kann, als es für die Ableitung des früheren PTWI-Wertes zugrunde gelegt wurde. Kritisch ist insbesondere das Passieren der Blut-Hirn-Schranke.
Die MAK-Kommission legte für die Exposition gegenüber Aluminium-, Aluminiumoxid- und Aluminiumhydroxid-haltigen Stäuben am Arbeitsplatz einen MAK-Wert in Höhe des Allgemeinen Staubgrenzwertes von 4 mg m−3 für die einatembare Fraktion und von 1,5 mg m−3 für die alveolengängige Fraktion fest. Der BAT-Wert beträgt 60 µg l−1 Urin.
1.2.2 Antimon
1.2.2.1 Vorkommen und relevante Expositionen
Antimon gehört zu den seltenen Elementen, ist aber aufgrund anthropogener Aktivitäten ubiquitär vorhanden. Es zählt wie Arsen zu den Halbmetallen und kommt hauptsächlich in Form von Sulfiden und Oxiden in den Oxidationsstufen −3, 0, +3 und +5 vor, wobei +3 die dominierende Oxidationsstufe ist. Durch den vielfältigen Einsatz von Antimon z. B. als Asbestersatz in Bremsbelägen, als Flammschutzmittel in Textilien, Kunststoffen und Papier, als Katalysator in Kunststoffen und als Pigment ist Antimon in der Umwelt weit verbreitet, vorwiegend als Sb2O3. Die Gehalte in Lebensmitteln sind gering; quantitativ bedeutender kann die Migration von Antimon aus Verpackungsmaterialien wie z. B. PET sein.
1.2.2.2 Toxische Wirkungen
Antimon wirkt als Kapillargift; weiterhin stehen Kardiotoxizität sowie Leberund Nierenschäden im Vordergrund. Damit ähneln akut toxische systemische Wirkungen denen des Arsens. Allerdings lösen hohe oral aufgenommene Konzentrationen an Antimon einen Brechreiz aus, sodass es schnell wieder ausgeschieden wird. Wie beim Arsen ist die Toxizität des Antimons stark abhängig von der Oxidationsstufe und der jeweiligen Verbindungsform; generell sind dreiwertige Verbindungen toxischer als fünfwertige und anorganische toxischer als organische. Das gasförmige Stibin besitzt die höchste akute Toxizität. Vermutungen, dass das als Flammschutzmittel in Matratzen eingesetzte Antimontrioxid für den plötzlichen Kindstod verantwortlich ist, haben sich nicht bestätigt. Inhalationsstudien mit Antimontrioxid und Stäuben von antimonhaltigen Erzen zeigten eine Induktion von Lungentumoren in weiblichen Ratten. Die genauen Wirkungsmechanismen sind allerdings noch unklar. Wie beim Arsen stehen eher indirekte genotoxische Effekte im Vordergrund, so die Induktion von oxidativem Stress und die Beeinflussung von DNA-Reparaturprozessen.
1.2.2.3 Grenzwerte und Einstufungen
In der Trinkwasserverordnung wurde der Grenzwert für Antimon in Trinkwasser und Mineralwässern 2003 auf 5 µg l−1 herabgesetzt. Basierend auf Versuchen an Ratten und hier anhand der Beeinflussung von Blutglucose- und Cholesterin-Werten veröffentlichte die amerikanische EPA eine „Reference dose“ (RfD-Wert) von 0,04 µg kg−1 KG Tag−1, allerdings auf schwacher Datenbasis. Von der WHO wurde ein TDI-Wert von 6 µg kg−1 KG festgelegt. Die MAK-Kommission stu...