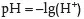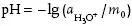![]()
Teil 1
pH-Messung
![]()
1
Einführung
1.1 pH
Das Kürzel pH ist vom lateinischen pondus hydrogenii (Gewicht des Wasserstoffs) oder auch vom lateinischen potentia hydrogenii (Wirksamkeit des Wasserstoffs) hergeleitet. Heute hat sich die drucktechnisch einfachere Schreibweise pH durchgesetzt.
Die ersten praktischen Erfahrungen mit dem pH machten wir mit Hilfe unseres Geschmackssinns. Wir stellten fest, dass es Lebensmittel und Getränke mit unterschiedlich saurem Geschmack gibt. Diese Feststellung trifft besonders auf Getränke und Früchte zu. Saure Getränke mit einem pH-Wert bis unter pH = 3 gelten als wohlschmeckend und erfrischend. Getränke mit pH-Werten am Neutralpunkt pH = 7 empfinden wir als fad und solche mit einem pH-Wert im basischen Bereich bei pH > 7 als ungenießbar.
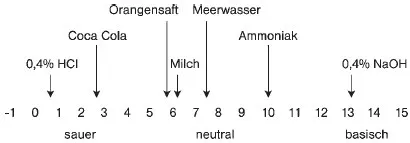
Der pH-Wert sagt somit aus, ob eine Lösung neutral, sauer oder basisch reagiert. Wie stark sauer oder basisch eine Lösung ist, ist an einer pH-Skale ablesbar. Bei pH = 7 reagiert eine Lösung neutral. Lösungen mit Werten unter pH = 7 reagieren sauer, und bei Werten über pH = 7 basisch. Beruht die basische Wirkung auf Alkaliionen, wie Natriumionen (z. B. Natronlauge) oder Kaliumionen (Kalilauge), so ist die Lösung alkalisch.
Für die saure Wirkung sind Oxoniumionen H3O+ verantwortlich und für die basische Wirkung sind es Hydroxidionen. In der Praxis verwendet man den Begriff Wasserstoffionen anstelle des korrekten Begriffes Oxoniumionen. Es ist zwar seit 1924 bekannt, dass es keine Wasserstoffionen in wässrigen Lösungen gibt. Der Begriff Wasserstoffionen ist jedoch derart verbreitet, dass der Begriff „Wasserstoff ionen“ praktisch ein Synonym für die „Oxoniumionen“ ist.
Die DIN 1319 Teil 1 unterscheidet zwischen der Messgröße und dem Zahlenwert.
Die Messgröße ist die physikalische Größe, die durch die Messung erfasst wird, z. B. die Temperatur, der pH oder der Druck.
Der Messwert ist der spezielle zu bildende Wert der Messgröße, er wird als Produkt aus Zahlenwert und Einheit angegeben, z. B. ϑ = 23 °C, pH = 7,6 oder p = 1050 hPa. Der pH-Wert hat hierbei die Einheit 1, die bei der Angabe des pH-Wertes entfällt.
Ursprünglich war die saure oder basische Wirkung einer Lösung der Wasserstoffionenkonzentration zugeordnet. Dies bedeutet in der Regel den Umgang mit sehr kleinen Zahlen, z. B. c(H+) = 0,000 000 001 mol/l bzw. c(H+) = 10−9 mol/l.
Sörensen vereinfachte diese Angabe, indem er den pH-Wert wie folgt definierte: „Der pH-Wert ist der negative, dekadische Logarithmus der Wasserstoffionenkonzentration“.
Heute ist bekannt, dass nicht die Konzentration, sondern die Aktivität der Wasserstoffionen den pH einer Lösung bestimmt. Das bedeutet, dass Lösungen mit gleichen Konzentrationen an Wasserstoffionen unterschiedlich sauer oder basisch reagieren können.
Weiterhin ist pH nicht mehr aufdas Volumen (Molarität), sondern auf die Masse (Molalität) der Lösung bezogen.
| 10 | 10 1 | −1 |
| 0,1 | 10−1 | 1 |
| 0,001 | 10−3 | 3 |
| 0,000 01 | 10−5 | 5 |
| 0,000 000 1 | 10−7 | 7 |
| 0,000 000 001 | 10−9 | 9 |
| 0,000 000 000 01 | 10−11 | 11 |
| 0,000 000 000 000 1 | 10−13 | 13 |
| 0,000 000 000 000 001 | 10−15 | 15 |
Die Definition lautet heute somit gemäß der Norm DIN 19260: „Der pH ist der negative dekadische Logarithmus der molalen Wasserstoffionenaktivität geteilt durch die Einheit der Molalität“.
Dementsprechend ist der pH gemäß der Norm DIN 19261 „ein Maß für die saure oder basische Wirkung einer wässrigen Lösung“ und der pH-Wert eine dimensionslose Zahl, die den pH charakterisiert. Er ist der mit (−1) multiplizierte, dekadische Logarithmus der molalen Wasserstoffionenaktivität.
Literatur: 1, 41, 42
1.2 pH in unserer Umgebung
pH-Skala
1.2.1 Mensch
Die meisten Lebensvorgänge in unserem Organismus funktionieren in neutralem oder leicht basischem Milieu. Ausnahmen sind der Säureschutzmantel der Haut und die Salzsäure im Magen. Die Flüssigkeiten in Darm und Bauchspeicheldrüse sind mit Werten um pH = 8,0 schwach alkalisch. Die Werte der Leber- und Gallensekrete und des Speichels liegen zwischen pH = 7,0 und pH = 7,1. Das Bindegewebe hat Werte zwischen pH = 7,1 und pH = 7,3. Die Werte des Harns ändern sich mehrmals am Tage zwischen sauer (pH = 4,8) und basisch (pH ≤ 8,0) und der Magensaft ist mit pH = 1,2 bis pH = 3,0 eindeutig sauer.
Die wichtigste Körperflüssigkeit, das Blut, hat einen relativ konstanten pH-Wert von pH = 7,4, der nur im Extremfall zwischen pH = 7,3 und pH = 7,8 schwankt. Bereits ein Absinken auf den Neutralwert pH = 7,0 oder ein Anstieg auf mehr als pH = 7,8 würde tödlich sein. Bedrohliche pH-Verschiebungen kommen im Blut allerdings selten vor.
Auch der gesunde Körper wird ständig mit Säuren konfrontiert. Er bildet Säuren bei der Zellatmung und beim Stoffwechsel. Für die Neutralisation und Ausscheidung säurereicher Speisen benötigt er daher basische Substanzen.
Neben psychischen Ursachen wie Stress, Angst und Depression verschieben auch Bewegungsmangel und Krankheiten der Verdauungsorgane auf Dauer die Säure-Basen-Balance.
Die Haut hat einen natürlichen Säureschutzmantel, der sie vor Krankheitserregern und anderen Umwelteinflüssen schützt. Ihr pH-Bereich liegt zwischen pH = 4,2 und pH = 6,7. Körperpflegemittel wie Seifen, Shampoos oder Cremes sollen diesen natürlichen Schutzmantel nicht schädigen, d. h. sie müssen pH-hautneutral sein.
Literatur: 2
1.2.2 Fleisch
Der pH-Wert in den Muskeln lebender Tiere liegt nahe dem Neutralpunkt. Nach dem Tod entsteht durch Abbau von Glykogen Milchsäure und der pH sinkt innerhalb von Stunden bis unter pH = 6. Für die fleischverarbeitende Industrie ist der Verlauf der pH-Änderung in den ersten Stunden nach der Schlachtung eines Tieres ein wertvolles Qualitätsmerkmal.
Bei einem Schweinemuskel sinkt der Wert innerhalb von 24 Stunden normalerweise aufetwa pH = 5,5. Beträgt der Wert bereits nach der ersten Stunde unter pH = 5,8, so handelt es sich um PSE- Fleisch (pale = blass, soft = weich, exucativ = wässrig). Dieses Fleisch hat ein vermindertes Wasserbindungsvermögen und ist besonders als Zusatz für die Rohwurstherstellung geeignet. Schweinefleisch, dessen pH auch noch nach 24 Stunden über pH = 6 liegt, ist DFD-Fleisch (dark = dunkel, firm = fest, dry = trocken). Dieses Fleisch hat ein besonders hohes Wasserbindungsvermögen. DFD-Fleisch ist auch nach dem Braten noch sehr saftig. Es ist besonders günstig für Kassler, Kochschinken, Kotelett und Schnitzel.
Dem DFD-Fleisch beim Schwein entspricht das dark cutting Fleisch beim Rind (dunkler Ausschnitt, leimige Oberfläche). Rindfleisch erreicht den End-pH jedoch erst nach 40 Stunden.
Der pH von schnell gereifter Wurst beträgt pH = 4,8 bis pH = 5,2. Bei Dauerwurst kann der Wert aufgrund der niedrigeren Wasseraktivität zwischen pH = 5,3 und pH = 5,8 liegen. Beim Altern der Wurst kann der pH sinken, sie wird sauer.
Bei verdorbenem Fisch nimmt der pH aufgrund der Bildung von Ammoniak und Aminen zu, er steigt auf Werte von pH = 7,5 bis zu pH = 8,0.
Literatur: 2, 3, 4, 11
1.2.3 Backwaren
Ein Teig geht nur bei niedrigem pH richtig auf. Brot hat bei hohen Werten ein zu geringes Volumen und ist unangenehm fest.
Bereits die Teigzutaten entscheiden, ob beim Backen die optimalen Bedingungen für die biologischen und chemischen Prozesse vorliegen. Bessere Mehlsorten zeichnen sich durch ihren niedrigen pH aus. Bei frischen Eiern liegen die Werte zwischen pH = 7,6 und pH = 8,0. Bereits nach einer Woche steigt er bis pH = 9,0 und erreicht nach einem Monat Werte bis pH = 9,7. Säurehaltige Backmittel helfen, die richtigen pH-Bedingungen für den Backprozess einzustellen.
Literatur: 10
1.2.4 Isoelektrischer Punkt
Bei Naturprodukten mit größeren Gehalten an Eiweißstoffen (z. B. Fleisch und Milch) bestimmt der pH deren chemisches Verhalten. Besonders für die industrielle Nutzung dieser Produkte ist die Kenntnis des pH-Verhaltens von Bedeutung.
Eiweißstoffe sind bei niedrigem pH-Wert positiv und bei einem hohen pH negativ geladen. Jeder Eiweißstoff hat einen individuellen pH, bei dem die elektrische Ladung Null ist, dieser pH-Wert ist der isoelektrische Punkt. In der Milch klumpt z. B. bei pH = 4,7 der Eiweißstoff Kasein aus. Bei der Fertigung von Milchprodukten endet daher der mikrobiologische Prozess in der Nähe dieses isoelektrischen Punktes.
In der Brautechnik dienen die elektrischen Eigenschaften der Eiweißstoffe auch zum Klären des Bieres. Beim Brauprozess denaturiert ein Teil der Eiweißstoffe durch das Kochen der Würze. Diese Eiweißstoffe können zu unerwünschten Trübungen führen. In der Nähe des isoelektrischen Punktes, in diesem Fall bei pH = 5, fallen nach Zugabe eines Flockungsmittels die Trübungen am effektivsten aus.
Ein weiteres Beispiel ist das Gerben von Häuten. Zwei für den Gerbprozess wichtige Substanzen sind das Kollagen und der Gerbstoff. Der isoelektrische Punkt des Kollagens liegt bei pH = 5 und der des Gerbstoffes bei pH = 2,5. Das Gerben erfolgt in einem Bereich zwischen pH = 3,5 und pH = 5,0. In diesem Bereich reagiert das positiv geladene Kollagen mit dem negativ geladenen Gerbstoff und führt zur Lederbildung der Haut.
Literatur: 2, 5
1.2.5 Milch und Milchprodukte
Die Frischmilch hat einen pH-Wert zwischen pH = 6,6 und pH = 6,8. Die in der Milch enthaltenen Bakterienstämme ernähren sich von der Laktose (Milchzucker). Bei dieser Fermentation (Gärung) entsteht Milchsäure, die Milch wird sauer. Am isoelektrischen Punkt (pH = 4,7 bei 20 °C) enthält die Milch etwa 0,5 bis 1% Säure und das in der Milch enthaltene Kasein fällt aus. Kasein ist nur eines der Milchproteine, den wesentlichen Anteil macht das Mol...