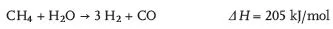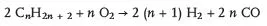![]()
1
Anorganische Grundprodukte
1.1 Wasserstoff und seine Verbindungen
1.1.1 Wasserstoff
Quergelesen
Die Gewinnung von Wasserstoff erfolgt typischerweise petrochemisch aus Kohlenwasserstoffen. Elektrolytische Verfahren sind insbesondere vor dem Hintergrund der Nutzung von Wasserstoff als chemischem Energiespeicher (seine Energiedichte beträgt 121 MJ/kg) interessant, machen derzeit aber nurca. 10% der Produktionskapazität aus. Neue Verfahrenskonzepte lassen gegenwärtig keine kurzfristige Umsetzbarkeit in den technischen Maßstab erkennen.
1.1.1.1 Allgemeines
Wasserstoff ist das häufigste Element im Universum; auf der Erde (Litho-, Hydro-, Bio- und Atmosphäre) ist er vornehmlich in Form von Wasser und Hydraten sowie als Bestandteil der Biomasse und fossiler Rohstoffe – mit einem Anteil von etwas unter 1% Massenanteil (etwa 15 Stoffmengenanteile in %, bezogen auf die Atome) – das neunthäufigste Element. Wasserstoff spielt in zahlreichen organisch-chemischen wie anorganisch-chemischen Prozessen eine tragende Rolle.
1.1.1.2 Wirtschaftliche Bedeutung und Verwendung
Wasserstoff gewinnt neben seiner großen Bedeutung als Chemierohstoff und Industriechemikalie insbesondere seit der ersten Ölkrise 1973/74 zunehmendes, wenn auch immer noch sehr spekulatives Interesse als praktisch unerschöpflicher (sekundärer) Energieträger (Brenn-, Kraftstoff) anstelle oder neben dem elektrischen Strom. Die Gründe liegen in der (gewichtsspezifisch) hohen Energiedichte von 121 kJ/g (Methan nur 50,3 kJ/g), der hohen Umweltverträglichkeit, seiner Ungiftigkeit und der guten Transport- und Speichermöglichkeiten.
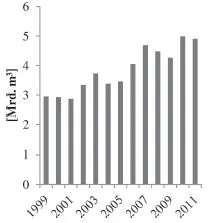
Die weltweite Produktion an Wasserstoff lag 2010 bei etwa 595 Mrd. m3, d.h. etwa 53 Mio. t. Für Deutschland wird im Jahr 2011 ein Produktionsvolumen von etwa 55 Mrd. m3 ausgewiesen. Die tatsächlichen Produktionszahlen dürften noch etwas höher liegen, da die Mengen, die in Raffinerien als Koppelprodukt anfallen und intern an anderer Stelle wieder eingesetzt werden, in den Zahlen nicht enthalten sind. Abbildung 1.1 zeigt den Verlauf der Wasserstoffproduktion in Deutschland seit 1999.
Abb. 1.1 Wasserstoffproduktion in Deutschland
88% des weltweit erzeugten bzw. als Zwangsanfall produzierten Wasserstoffes werden direkt beim Erzeuger weiterverarbeitet. Dadurch, dass Raffinerien verstärkt dazu übergehen, anstelle eigener Wasserstoffanlagen Fremdanlagen von Fachfirmen zu nutzen, dürfte der Anteil des über den Markt abgesetzten Wasserstoffes in Zukunft ansteigen.
Die Nutzung von Wasserstoff erfolgt überwiegend für die Ammoniaksynthese und für Raffinerieprozesse (z.B. Hydrocracken zur Verbesserung der Qualität von Erdölprodukten; Hydrotreating, z.B. hydrierende Entschwefelung).
Im unteren Prozentbereich wird er ebenfalls für die Methanolsynthese, Hydrierungen in der organischen Chemie (Fetthärtung, Anilin- und Cyclohexansynthese), in der Elektronik (Schutzgas bei der Halbleiterherstellung), in der Metallurgie (z.B. in Form von Synthesegas zur Direktreduktion von Eisenschwamm, als Reduktions- oder Schutzgas bei Temper- und Umschmelzprozessen), in der Glasindustrie, zur Chlorwasserstoffherstellung sowie zum autogenen Schweißen und Schneiden (Knallgasgebläse) und in der Schutzgasschweißtechnik (z.B. mit Argon/Wasserstoff) benötigt. In der Kraftwerkstechnik dient Wasserstoff aufgrund seiner hohen Wärmekapazität als Kühlmedium für Generatoren (Abb. 1.2).
Das Einsatzgebiet der Erdölraffination wächst zurzeit am stärksten. Dies ist einerseits durch die Umweltgesetzgebung in den Industrieländern bedingt, die einen höheren Wasserstoffeinsatz erfordert, andererseits durch den steigenden Anteil von hochsiedenden Kohlenwasserstoffen, die wasserstoffärmer sind als niedrigsiedende Kohlenwasserstoffe.
Der Wasserstoffanteil, der in den Handel kommt, wird i.A. in gasförmiger oder flüssiger Form befördert. Zum Teil wird er gasförmig in komprimierter Form (z.B. 20 MPa) in Stahlzylindern oder Flaschenbündeln oder flüssig (kryogen) bei –253 °C in hochisolierten Drucktankwagen transportiert. Auch durch Rohrleitungen kann Wasserstoff verteilt werden. In Deutschland wird im Rhein-Ruhr-Gebiet bereits seit Jahrzehnten ein über 200 km langes (Druck-) Rohrleitungsnetz betrieben, der Wasserstoffverbund Rhein-Ruhr, an das eine größere Zahl von wasserstofferzeugenden bzw. -verbrauchenden Industrieanlagen angeschlossen ist.
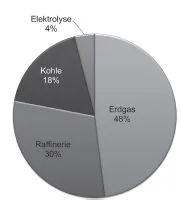
Abb. 1.2 Anteil der Verfahren an der Wasserstoffproduktion
Ähnliche Rohrleitungsnetze sind in Europa, z.B. in den Niederlanden, Belgien und Frankreich, eingerichtet.
In der fortgeschrittenen Entwicklung befindet sich die Speicherung bzw. der Transport von Wasserstoff in festem Zustand in Form von Hydriden wie Titan/Eisenhydrid Ti-FeH1.95 oder Magnesium/Nickelhydrid MgNiH4.2.
1.1.1.3 Vorkommen und Rohstoffe
Wasserstoff kommt auf der Erde hauptsächlich in Form von Wasser vor, daneben in gebundener Form in Kohlenwasserstoffen wie z.B. Methan, CH4, sowie Kohlenhydraten, CnH2nOn. Elementar kommt Wasserstoff sowohl in Spuren in der Erdkruste vor als auch in der Atmosphäre. Dabei ist er in den unteren Schichten mit ~0,5 ppm nur spurenweise vertreten, während die obersten, leichten Schichten der Erdatmosphäre nahezu ausschließlich aus H2 bestehen.
Für die technische Wasserstoffgewinnung muss H2 daher aus seinen Verbindungen befreit werden; als wichtigste Rohstoffe sind hier Wasser und Methan zu nennen.
1.1.1.4 Herstellung von Wasserstoff
Wasserstoff wird nach zwei prinzipiell verschiedenen Verfahren großtechnisch hergestellt:
- durch petrochemische Prozesse einschließlich Kohlevergasung
- durch Elektrolyse von Wasser
Daneben fällt Wasserstoff in großen Mengen als Nebenprodukt bei Verarbeitungsprozessen der Petrochemie, der Raffinerien und Kokereien (Koksofengas) sowie bei manchen chemischen und elektrochemischen Verfahren, z.B. der Chloralkalielektrolyse, an. Sonstige Verfahren spielen technisch entweder (noch) keine Rolle oder betreffen Sonderfälle.
1.1.1.4.1 Petrochemische Verfahren und Kohlevergasung
Das wichtigste Verfahren zur Herstellung von Wasserstoff ist die katalytische allotherme Dampfspaltung (Steam-Reforming) von Erdgas (Methan) oder von leichten Erdölfraktionen (Propan, Butan, Naphtha bis Siedeende von 200 °C). Hierbei stammt der erzeugte Wasserstoff teilweise aus dem eingesetzten Wasserdampf, teilweise aus den Kohlenwasserstoffen; bei der Methanspaltung stammen ein Drittel aus Wasser und zwei Drittel aus Methan:
Etwa 80% des verbrauchten Wasserstoffs werden petrochemisch erzeugt, einschließlich der thermischen oder katalytischen Spaltung von Kohlenwasserstoffen, z.B. in Raffinerien.
In den USA werden über 90% des Wasserstoffs nach diesem derzeit kostengünstigsten Verfahren aus Erdgas hergestellt. In anderen Wirtschaftsräumen ist der Anteil geringer.
Neben dem Steam-Reforming von niedrig siedenden Kohlenwasserstoffen ist vor allem die partielle Oxidation von schwerem Heizöl und Erdölrückständen nach der Bruttogleichung
von Bedeutung. Die Reaktion verläuft ohne Katalysator und sie ist autotherm.
In Ländern mit billiger Kohle wird Wasserstoff zunehmend durch Kohle/Koksvergasung produziert (vor dem 2. Weltkrieg wurden weltweit 90% des Wasserstoffs nach diesem Verfahren erzeugt). Die Reaktion verläuft nach der Gleichung:
Da über die Hälfte des Wasserstoffs zur Ammoniakerzeugung (Düngemittelproduktion) dient und diese in modernen Ammoniakanlagen (Wasserstofferzeugung und -weiterverarbeitung in „Einstranganlagen“) erfolgt, sind alle drei Verfahren ausführlich in Abschnitt 1.2.4 abgehandelt.
1.1.1.4.2 Elektrolyse von Wasser
Die elektrolytische Zerlegung von Wasser spielt derzeit nur eine untergeordnete Rolle – ihr Anteil lag im Jahr 2010 unter 4% –, da der Prozess sehr energieaufwendig ist; der gesamte Wirkungsgrad der Elektrolyse einschließlich Stromerzeugung beträgt 20–25%. Nur in Sonderfällen sind Großanlagen errichtet worden, vor allem in der Nähe von Staudämmen, z.B. in Ägypten (Anlage am Assuan-Staudamm: Leistung 33 000 m3/h für die Ammoniaksynthese), Indien, Peru, in Ländern mit niedrigem Strompreis oder auch bei günstigem Absatz des Koppelproduktes Sauerstoff, z.B. in Norwegen. Auch wenn sehr reiner Wasserstoff benötigt wird, z.B. in der Nahrungsmitteltechnologie (Margarineherstellung) oder bei Kleinverbrauchern, stellt man Wasserstoff durch Elektrolyse her. Das Verfahren könnte aber im Rahmen der langfristig angestrebten Wasserstofftechnologie („Nach-Erdöl-Zeitalter“) eine große Bedeutung erlangen.
Die alkalische Elektrolysezelle zum Zerlegen des Wassers besteht im Prinzip aus zwei Elektroden, getrennt durch ein gasundurchlässiges Diaphragma, die in den Elektrolyten (Wasser mit Zusatz von Kaliumhydroxid zur Erhöhung der Leitfähigkeit) eintauchen. Die Elektrolysetemperatur beträgt 80–85 °C. Die theoretische Zersetzungsspannung liegt bei 1,23 V, die tatsächlich aufzubringende bei 1,9–2,3 V (Überspannungseffekte u.a.). An der Anode entwickelt sich Sauerstoff, an der Kathode Wasserstoff:
Der spezifische Energiebedarf pro m3 Wasserstoff (und 0,5 m3 Sauerstoff) liegt bei 4,5–5,45 kWh.
Technische Zellen sind meist bipolar, d.h. elektrisch in Reihe, verschaltet und bestehen aus einer Vielzahl von hintereinandergeschalteten Einzelplattenzellen, die nach dem Filterpressenprinzip in Blöcken zusammengefügt sind. Bei einer Elektrolyse unter Druck kann der Energieverbrauch um 20% gesenkt werden. Weitere Neuentwicklungen betreffen die Verwendung von porösen Elektroden, die Hochtemperatur-Dampfphasenelektrolyse und das PEM-Verfahren (proton exchange membrane). Als Nebenprodukt der Wasserelektrolyse kann schweres Wasser D2O gewonnen werden, das sich im Elektrolyten anreichert.
1.1.1.4.3 Sonstige Verfahren zur Herstellung von Wasserstoff Wasserstoff aus Ammoniak
Durch thermische Zersetzung von Ammoniak am Nickelkontakt bei 900 °C (für Hydrierungen oder metallurgische Zwecke) werden Wasserstoff und Stickstoff erhalten:
Die Reaktion entspricht der Umkehrung der Ammoniaksynthese. Sie wird in Kleinanlagen betrieben.
Thermische Wasserspaltung
Die rein thermische Spaltung von Wasser gemäß
ist wegen der erforderlichen Temperatur von über 2000 °C technisch nicht sinnvoll.
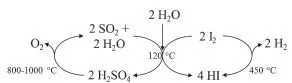
Dagegen kommen mehrstufige thermochemische Kreisprozesse, von denen eine Vielzahl thermodynamisch möglich, aber nicht technisch ausgereift ist, mit niedrigeren Temperaturen aus. Hierbei wird Wasser mit Hilfe eines im Kreis geführten Hilfsstoffes zersetzt, und die Reaktionsprodukte werden – teilweise über Zwischenstufen – thermisch gespalten. Ein Beispiel ist folgender Schwefel-Iod-Kreisprozess:
Problematisch sind vor allem Werkstoff- und Korrosionsfragen sowie die Erzeugung der benötigten hohen Temperaturen (ggf. nukleare Prozesswärme oder auch Solarenergie).
In Sonderfällen wird Wasserstoff durch katalytische Zersetzung von Methanol oder Ammoniak (1.1.1.4.3) in Spaltanlagen hergestellt.
1.1.1.4.4 Gewinnung von Wasserstoff als Nebenprodukt
Bei der Verarbeitung von Rohöl in Raffinerien fallen durch Cyclisierung und Aromatisierung, z.B. durch katalytische Reformingprozesse, große Mengen wasserstoffhaltiger Gase an (Raffineriegas).
Dieser Wasserstoff wird aber meist im eigenen Betrieb für Hydrierzwecke verwendet. Auch bei anderen petrochemischen und chemischen Prozessen (Synthese von Olefinen, Acetylen, Styrol, Aceton) fällt Wasserstoff an. Koksofengas enthält über 50% Wasserstoff (Volumenanteil), der daraus isoliert werden kann. Schließlich entsteht Wasserstoff als wertvolles Nebenprodukt bei der Chloralkalielektrolyse (direkt beim Diaphragmaverfahren oder indirekt beim Amalgamverfahren) sowie bei der Salzsäureelektrolyse; zur Gewinnung von Wasserstoff nach d...