
eBook - ePub
Massanalyse
Titrationen mit chemischen und physikalischen Indikationen
This is a test
- 410 Seiten
- German
- ePUB (handyfreundlich)
- Über iOS und Android verfügbar
eBook - ePub
Massanalyse
Titrationen mit chemischen und physikalischen Indikationen
Angaben zum Buch
Buchvorschau
Inhaltsverzeichnis
Quellenangaben
Über dieses Buch
Dieses Standardwerk der analytischen Chemie behandelt die Grundlagen der Maßanalyse - sowohl die Theorie als auch wichtige Apparate und praktische Anwendungen. Alle Titrationsarten werden ausführlich und anhand von konkreten Beispielen behandelt. Das Buch enthält zusätzlich eine Einführung in die instrumentelle Maßanalyse. Ein unverzichtbares Buch für das Praktikum in quantitativer anorganischer Analyse.
- Standardwerk zur Theorie und Praxis der Titrationen für das Praktikum in quantitativer anorganischer Analyse
-
- Mit zahlreichen Beispielen und klar gekennzeichneten Arbeitsvorschriften
-
Häufig gestellte Fragen
Gehe einfach zum Kontobereich in den Einstellungen und klicke auf „Abo kündigen“ – ganz einfach. Nachdem du gekündigt hast, bleibt deine Mitgliedschaft für den verbleibenden Abozeitraum, den du bereits bezahlt hast, aktiv. Mehr Informationen hier.
Derzeit stehen all unsere auf Mobilgeräte reagierenden ePub-Bücher zum Download über die App zur Verfügung. Die meisten unserer PDFs stehen ebenfalls zum Download bereit; wir arbeiten daran, auch die übrigen PDFs zum Download anzubieten, bei denen dies aktuell noch nicht möglich ist. Weitere Informationen hier.
Mit beiden Aboplänen erhältst du vollen Zugang zur Bibliothek und allen Funktionen von Perlego. Die einzigen Unterschiede bestehen im Preis und dem Abozeitraum: Mit dem Jahresabo sparst du auf 12 Monate gerechnet im Vergleich zum Monatsabo rund 30 %.
Wir sind ein Online-Abodienst für Lehrbücher, bei dem du für weniger als den Preis eines einzelnen Buches pro Monat Zugang zu einer ganzen Online-Bibliothek erhältst. Mit über 1 Million Büchern zu über 1.000 verschiedenen Themen haben wir bestimmt alles, was du brauchst! Weitere Informationen hier.
Achte auf das Symbol zum Vorlesen in deinem nächsten Buch, um zu sehen, ob du es dir auch anhören kannst. Bei diesem Tool wird dir Text laut vorgelesen, wobei der Text beim Vorlesen auch grafisch hervorgehoben wird. Du kannst das Vorlesen jederzeit anhalten, beschleunigen und verlangsamen. Weitere Informationen hier.
Ja, du hast Zugang zu Massanalyse von Gerhard Schulze, Jürgen Simon, Ralf Martens-Menzel, Gerhard Schulze,Jürgen Simon,Ralf Martens-Menzel im PDF- und/oder ePub-Format sowie zu anderen beliebten Büchern aus Naturwissenschaften & Analytische Chemie. Aus unserem Katalog stehen dir über 1 Million Bücher zur Verfügung.
Information
1Einführung und Grundbegriffe
Das Ziel einer quantitativen chemischen Analyse ist die Beantwortung der Frage, wie viel von einem gesuchten Stoff in einer Substanzprobe enthalten ist. Die Methoden, mit denen dieses Ziel erreicht wird, lassen sich in klassische und physikalische Analysenmethoden einteilen.
Als klassische Methoden werden hier diejenigen bezeichnet, bei denen nach einer chemischen Umsetzung eine Masse- oder eine Volumenbestimmung vorgenommen wird. Die Berechnung der Quantität des gesuchten Stoffes aus dem Messwert erfolgt mithilfe von stöchiometrischen Umrechnungsfaktoren, die in einfacher Weise aus den molaren Massen der an der Reaktion beteiligten Stoffe abgeleitet werden können.
Bei den physikalischen Methoden dagegen wird eine konzentrationsabhängige physikalische Eigenschaft des gesuchten Stoffes gemessen und aus dem Wert der Messgröße seine Konzentration bzw. seine Masse oder Stoffmenge errechnet. Der jeweilige Umrechnungsfaktor hängt von den chemischen, physikalischen und apparativen Versuchsbedingungen ab. Er wird nicht theoretisch abgeleitet, sondern durch Messungen an Lösungen bekannter Konzentration oder an Substanzproben mit bekannten Gehalten experimentell ermittelt. Da die Messungen spezielle Geräte erfordern, nennt man diese Analysenmethoden auch instrumentelle Methoden.
Den klassischen Bestimmungsmethoden liegen im wesentlichen zwei Analysenprinzipien zugrunde, das der
–Gravimetrie oder Gewichtsanalyse und das der
–Titrimetrie oder Maßanalyse.1
Gravimetrie und Titrimetrie
Das Analysenprinzip der Gravimetrie basiert auf der Bestimmung der Masse des Reaktionsproduktes einer Fällungsreaktion. Alle der Gravimetrie zuzuordnenden Bestimmungsverfahren sind grundsätzlich durch folgendes Vorgehen gekennzeichnet: Durch Zufügen einer geeigneten Reagenslösung zur Analysenlösung wird der zu bestimmende Stoff unter festgelegten Arbeitsbedingungen in eine schwer lösliche Verbindung übergeführt. Der Niederschlag wird abgetrennt und nach geeigneter Behandlung ausgewogen. Folgende Voraussetzungen müssen für den erfolgreichen Einsatz der Gravimetrie erfüllt sein:
–Die Ausfällung muss quantitativ erfolgen, d. h. der aufgrund der geringen Löslichkeit des Reaktionsproduktes in der Lösung verbleibende Rest des zu bestimmenden Stoffes muss so klein sein, dass seine Masse unterhalb der Ablesbarkeit der benutzten Analysenwaage liegt.
–Der Niederschlag muss eine konstante und bekannte stöchiometrische Zusammensetzung aufweisen bzw. durch nachfolgende Operationen in eine Verbindung übergeführt werden können, die diese Bedingung erfüllt.
–Der Niederschlag muss eine genaue Massenbestimmung zulassen, d. h. er darf sich auf der Waage nicht verändern.
Beispiel: Das in einer Eisen(III)-Salzlösung enthaltene Eisen(III) soll auf gravimetrischem Wege bestimmt werden. Dazu wird die saure Probelösung zum Sieden erhitzt und unter Rühren tropfenweise mit Ammoniaklösung bis zum Überschuss versetzt. Es fällt ein brauner Niederschlag von Eisen(III)-oxidhydrat, Fe2O3 · x H2O, aus. Er wird durch Filtrieren von der Lösung abgetrennt und durch Auswaschen mit heißem, ammoniumnitrathaltigem Wasser von anhaftenden Begleitstoffen so weit wie möglich befreit. Die abgeschiedene Verbindung ist die Fällungsform. Sie erfüllt die erste der oben aufgeführten Forderungen. Wegen des schwankenden Wassergehaltes und des möglichen Vorhandenseins von basischen Salzen ist die Zusammensetzung jedoch nicht konstant. Durch Glühen im Porzellantiegel wird der Niederschlag in die Wägeform übergeführt, die auch den anderen beiden Forderungen genügt. Es entsteht beim Glühen Eisen(III)-oxid, Fe2O3, das stöchiometrisch zusammengesetzt ist und weder Wasser noch Kohlenstoffdioxid aus der Luft anzieht. Es lässt sich bequem und exakt zur Wägung bringen. Aus der Masse des Eisen(III)-oxids, m(Fe2O3), wird mithilfe des stöchiometrischen Faktors F die Masse des gesuchten Bestandteiles Eisen, m(Fe), berechnet:
m(Fe) = F · m(Fe2O3) ,
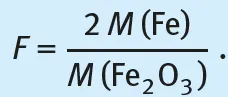
Den Faktor F erhält man aus den molaren Massen von Eisen, M(Fe) = 55,845 g/mol, und von Eisen(III)-oxid, M(Fe2O3) = 159,688 g/mol zu F = 0,6994.
Um bei einer gravimetrischen Bestimmung die quantitative Abscheidung des zu bestimmenden Stoffes zu erreichen, muss das jeweilige Reagens im Überschuss angewendet werden. Das ist ein Charakteristikum gravimetrischer Verfahren.
Das Analysenprinzip der Titrimetrie beruht auf der Messung des Volumens einer Reagenslösung bekannter Konzentration, die man als Maßlösung bezeichnet. Von dem Reagens wird bei den titrimetrischen Verfahren der Analysenlösung (Probelösung) nur so viel in Form der Maßlösung2 hinzugefügt, wie für die chemische Umsetzung des zu bestimmenden Stoffes gerade erforderlich ist, d. h. die äquivalente Stoffmenge. Aus dem Volumen der Maßlösung, das bis zum Erreichen dieses Punktes (Äquivalenzpunkt, theoretischer oder stöchiometrischer Endpunkt) benötigt wird, und ihrer Konzentration, die allerdings genau bekannt sein muss, lässt sich bei Kenntnis des Reaktionsablaufs die Masse des gesuchten Stoffes berechnen. Den gesamten Vorgang bezeichnet man als Titration.
Beispiel: Es soll das in einer schwefelsauren Lösung von Eisen(II)-sulfat enthaltene Eisen(II) durch eine Titration bestimmt werden. Dazu läßt man in die Analysenlösung eine Kaliumpermanganatlösung einfließen. Die Eisen(II)-Ionen werden von den Permanganationen zu Eisen(III)-Ionen oxidiert, während gleichzeitig die violetten Permanganationen zu nahezu farblosen Man-gan(II)-Ionen reduziert werden:

Sobald die gegen Ende der Titration langsam eintropfende Permanganatlösung praktisch alle Eisen(III)-Ionen oxidiert hat, wird der nächste Tropfen der Reagenslösung nicht mehr entfärbt, so dass die titrierte Lösung rosafarben erscheint. Damit ist der Endpunkt der Titration erreicht, die Umsetzung ist quantitativ erfolgt. Die Kaliumpermanganatlösung wird aus einer geeigneten Vorrichtung, einer Bürette, zugegeben, an der man das bis zum Endpunkt der Titration verbrauchte Volumen ablesen kann. Aufgrund der oben angegebenen Reaktionsgleichung lässt sich aus dem Volumen der Maßlösung in ml, V (M), und ihrer Konzentration die gesuchte Masse des Eisens in mg, m(Fe), nach
m (Fe) = F · V(M)
berechnen. Der Faktor F (herkömmlich als maßanalytisches Äquivalent bezeichnet) in mg/ml ergibt sich aus der molaren Masse des Eisens und der Stoffmengenkonzentration der Permanganatlösung, beide bezogen auf Äquivalente. Die beiden Größen lassen sich in einfacher Weise aus den molaren Massen der miteinander umgesetzten Stoffe mithilfe der Äquivalentzahlen berechnen, die der Reaktionsgleichung zu entnehmen sind (vgl. S. 54 ff.).
Maßanalytische Bestimmungen sind an folgende drei Voraussetzungen geknüpft:
–Die der Titration zugrunde liegende chemische Reaktion muss schnell, quantitativ und eindeutig in der Weise ablaufen, wie die Reaktionsgleichung angibt.
–Es muss möglich sein, eine Reagenslösung definierter Konzentration herzustellen oder die Konzentration der Lösung auf geeignetem Wege exakt zu bestimmen.
–Der Endpunkt der Titration muss deutlich zu erkennen sein. Er soll mit dem Äquivalenzpunkt, an dem gerade die der Stoffmenge des gesuchten Stoffes äquivalente Reagensmenge zugefügt wurde, zusammenfallen oder zumindest ihm sehr nahe kommen.
Die dritte Forderung verlangt in der Regel zusätzliche Maßnahmen, denn nur in wenigen Fällen ist der Titrationsendpunkt so leicht zu erkennen wie in dem beschriebenen Beispiel, in dem die Reagenslösung eine starke Eigenfarbe aufweist, die während der Umsetzung verschwindet. Oft wird der Endpunkt durch Zusatz ei...
Inhaltsverzeichnis
- Cover
- Titelseite
- Impressum
- Vorwort zur 19. Auflage
- Inhalt
- 1 Einführung und Grundbegriffe
- 2 Praktische Grundlagen der Maßanalyse
- 3 Maßanalysen mit chemischer Endpunktbestimmung
- 4 Maßanalysen mit physikalischer Endpunktbestimmung
- 5 Instrumentelle Maßanalyse
- 6 Überblick über die Geschichte der Maßanalyse
- Anhang
- Literaturverzeichnis
- Namensregister
- Sachregister