
This is a test
- German
- ePUB (handyfreundlich)
- Über iOS und Android verfügbar
eBook - ePub
Chemie für Ingenieure
Angaben zum Buch
Buchvorschau
Inhaltsverzeichnis
Quellenangaben
Über dieses Buch
Die 14. Auflage dieses Klassikers bietet eine umfassende praxisorientierte Einführung in die für Ingenieure relevante Chemie. Vollständig überarbeitet und aktualisiert ist das Buch besonders für Ingenieure in Bachelor- und Diplomstudiengängen konzipiert.
Häufig gestellte Fragen
Gehe einfach zum Kontobereich in den Einstellungen und klicke auf „Abo kündigen“ – ganz einfach. Nachdem du gekündigt hast, bleibt deine Mitgliedschaft für den verbleibenden Abozeitraum, den du bereits bezahlt hast, aktiv. Mehr Informationen hier.
Derzeit stehen all unsere auf Mobilgeräte reagierenden ePub-Bücher zum Download über die App zur Verfügung. Die meisten unserer PDFs stehen ebenfalls zum Download bereit; wir arbeiten daran, auch die übrigen PDFs zum Download anzubieten, bei denen dies aktuell noch nicht möglich ist. Weitere Informationen hier.
Mit beiden Aboplänen erhältst du vollen Zugang zur Bibliothek und allen Funktionen von Perlego. Die einzigen Unterschiede bestehen im Preis und dem Abozeitraum: Mit dem Jahresabo sparst du auf 12 Monate gerechnet im Vergleich zum Monatsabo rund 30 %.
Wir sind ein Online-Abodienst für Lehrbücher, bei dem du für weniger als den Preis eines einzelnen Buches pro Monat Zugang zu einer ganzen Online-Bibliothek erhältst. Mit über 1 Million Büchern zu über 1.000 verschiedenen Themen haben wir bestimmt alles, was du brauchst! Weitere Informationen hier.
Achte auf das Symbol zum Vorlesen in deinem nächsten Buch, um zu sehen, ob du es dir auch anhören kannst. Bei diesem Tool wird dir Text laut vorgelesen, wobei der Text beim Vorlesen auch grafisch hervorgehoben wird. Du kannst das Vorlesen jederzeit anhalten, beschleunigen und verlangsamen. Weitere Informationen hier.
Ja, du hast Zugang zu Chemie für Ingenieure von Jan Hoinkis im PDF- und/oder ePub-Format sowie zu anderen beliebten Büchern aus Naturwissenschaften & Chemie. Aus unserem Katalog stehen dir über 1 Million Bücher zur Verfügung.
Information
1
Atombau und Periodensystem
Das erste Kapitel führt uns zu den kleinsten Bestandteilen der stofflichen Welt, da Grundkenntnisse über deren Aufbau wichtig zum Verständnis vieler stofflicher Eigenschaften und Veränderungen sind. Besonders das wellenmechanische oder quantenmechanische Atommodell trägt dazu bei, später viele chemische Gesetzmäßigkeiten mühelos verstehen zu können. Dabei werden u. a. auch einige erkenntniskritische Überlegungen angestellt, denn die Erkenntnisse der Quantenmechanik haben seit Beginn dieses Jahrhunderts unser Weltbild vollkommen umgestaltet. Ein vertieftes Verständnis dieser Sachverhalte ermöglicht es dann, die uns umgebende Wirklichkeit besser begreifen zu können.
1.1 Bestandteile des Atoms
Ein Atom besteht aus einem Atomkern und einer Elektronenhülle. Bei chemischen Reaktionen treten Veränderungen in der Elektronenhülle auf.
| Atomdurchmesser: | Größenordnung 10−10m |
| Atomkerndurchmesser: | Größenordnung 10−14m |
Der Kern enthält die elektrisch positiv geladenen Protonen und die elektrisch neutralen Neutronen. Beide haben etwa die gleiche Masse und werden als Nukleonen bezeichnet (nucleus, lat. = Kern; Nukleonen = Kernbestandteile). Die Atomhülle wird aus den elektrisch negativ geladenen Elektronen gebildet. Nukleonen und Elektronen sind Elementarteilchen und besitzen die in Tab. 1.1 angegebenen Massen bzw. elektrischen Ladungen. Zum Vergleich, um sich die Größenverhältnisse besser vorstellen zu können: Wäre der Atomkern so groß wie ein Stecknadelkopf (ca. 1mm), hätte das Atom die Ausdehnung eines Fußballfelds (ca. 100m).
Die Eigenschaften der Atome werden entscheidend durch die Außenelektronen bestimmt. Die Anzahl der Elektronen in der Hülle hängt aber ihrerseits von der Anzahl der Protonen im Kern ab, sodass letztlich die Protonenzahl das maßgebende Unterscheidungsmerkmal für die verschiedenen Atomarten darstellt. Hinsichtlich der Protonenzahl gibt es 103 verschiedene Atomarten1).
Tab. 1.1 Elementarteilchen.
| Name | Symbol | Ruhemasse | elektrische Ladung | Einheiten |
| Proton | p+ | 1,672 61 · 10−24 g | +1,6 · 10−19 | As, Ampèresekunden oder C, Coulomb |
| Neutron | n | 1,674 92 · 10−24 g | – | |
| Elektron | e− | 0,910 96 · 10−27 g | −1,6 · 10−19 | As, Ampèresekunden oder C, Coulomb |
Stoffe, die nur aus einer dieser Atomarten mit jeweils der gleichen Protonenzahl bestehen, nennt man chemische Elemente. Man kennzeichnet die chemischen Elemente durch Symbole; diese sind Abkürzungen des lateinischen Namens, bestehend aus einem oder zwei Buchstaben, z.B. H für Hydrogenium (Wasserstoff); O für Oxygenium (Sauerstoff); N für Nitrogenium (Stickstoff); C für Carbonium (Kohlenstoff); S für Sulfur (Schwefel); Na für Natrium (deutsch ebenfalls Natrium); Fe für Ferrum (Eisen); Cu für Cuprum (Kupfer); Zn für Zincum (Zink); Sn für Stannum (Zinn); Hg für Hydrargyrum (Quecksilber) usw. Die im deutschen Sprachgebrauch üblichen Elementnamen sind mit den Elementsymbolen und der jeweiligen Protonenzahl im Kern (= Ordnungszahl) im Anhang A.4 zu finden.
1.2 Atomkerne
Fast die gesamte Masse eines Atoms ist im Kern vereinigt. Der Kern erfüllt aber nur ca. ein Billionstel des gesamten Atomvolumens. Ein anschaulicher Vergleich: Die Atomkerne eines Eisenwürfels von 10m Kantenlänge ergäben, ohne die Elektronenhüllen dicht zusammengepackt, einen Würfel von weniger als 1mm3 Rauminhalt, aber mit einer Masse von 7900 t!
Die Massenzahl gibt an, wie viele Nukleonen (Protonen + Neutronen) ein Atomkern enthält. Sie wird links oben vor das Elementsymbol oder hinter das Elementsymbol geschrieben, also z.B.: 235U; 238U; bzw. U 235; U 238.
Die Kernladungszahl oder Ordnungszahl zeigt die Anzahl der Protonen im Kern und damit das chemische Element an. Sie steht unten links vor dem Elementsymbol. Man schreibt sie jedoch meistens nicht, weil das Elementsymbol indirekt die Protonenanzahl angibt, z.B. 92U bzw. U mit Massenzahl:
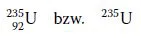
Werden aber Reaktionen beschrieben, bei denen sich die Kernladungszahl und damit auch das chemische Element ändert, ist es zweckmäßig, die Ordnungszahl zu schreiben.
Die Neutronenzahl errechnet sich aus der Differenz zwischen Massenzahl und Ordnungszahl. Durch die Neutronen werden die positiv geladenen Protonen im Kern zusammengehalten. Die Elemente bis zur Ordnungszahl 20 haben etwa gleich viele Neutronen wie Protonen, bei den höheren Elementen überwiegen die Neutro...
Inhaltsverzeichnis
- Cover
- Table of Contents
- Title
- Copyright
- Vorwort
- 1: Atombau und Periodensystem
- 2: Die chemische Bindun
- 3: Die Aggregatzustände
- 4: Chemische Reaktionen
- 5: Chemische Gleichgewichte
- 6: Die Elemente
- 7: Anorganische Verbindungen
- 8: Organische Verbindungen
- 9: Kunststoffe
- 10: Elektrochemie
- 11: Spektren und ihre Anwendungen
- 12: Biochemie und Biotechnologie
- 13: Umwelttechnik
- Anhang
- Sachverzeichnis
- End User License Agreement