
This is a test
- 110 páginas
- Spanish
- ePUB (apto para móviles)
- Disponible en iOS y Android
eBook - ePub
Más allá de la herrumbre, I
Detalles del libro
Vista previa del libro
Índice
Citas
Información del libro
La corrosión es un fenómeno químico de todos conocido. Desde que el hombre encontró la forma de obtener metales a partir de los minerales que los contienen, revirtió el proceso natural que lleva a los metales, en combinación con otros elementos, a integrar formaciones geológicas. Con la lectura de este libro, el lector reconocerá el papel central que desempeñan la ciencia y la tecnología química en la preservación de los objetos metálicos.
Preguntas frecuentes
Por el momento, todos nuestros libros ePub adaptables a dispositivos móviles se pueden descargar a través de la aplicación. La mayor parte de nuestros PDF también se puede descargar y ya estamos trabajando para que el resto también sea descargable. Obtén más información aquí.
Ambos planes te permiten acceder por completo a la biblioteca y a todas las funciones de Perlego. Las únicas diferencias son el precio y el período de suscripción: con el plan anual ahorrarás en torno a un 30 % en comparación con 12 meses de un plan mensual.
Somos un servicio de suscripción de libros de texto en línea que te permite acceder a toda una biblioteca en línea por menos de lo que cuesta un libro al mes. Con más de un millón de libros sobre más de 1000 categorías, ¡tenemos todo lo que necesitas! Obtén más información aquí.
Busca el símbolo de lectura en voz alta en tu próximo libro para ver si puedes escucharlo. La herramienta de lectura en voz alta lee el texto en voz alta por ti, resaltando el texto a medida que se lee. Puedes pausarla, acelerarla y ralentizarla. Obtén más información aquí.
Sí, puedes acceder a Más allá de la herrumbre, I de Javier Ávila, Joan Genescá en formato PDF o ePUB, así como a otros libros populares de Sciences physiques y Chimie organique. Tenemos más de un millón de libros disponibles en nuestro catálogo para que explores.
Información
Categoría
Sciences physiquesCategoría
Chimie organiqueIII. La física y la química de la corrosión. La corrosión metálica como ciencia aplicada
YA EN EL capítulo II habíamos mencionado que algunos metales son más activos que otros debido a la energía acumulada que poseen. En el presente capítulo haremos hincapié en la naturaleza de dichas energías, su cuantificación y los efectos que acarrean durante un proceso de corrosión.
La experiencia nos ha enseñado que todos los metales que conocemos poseen diferentes tendencias a corroerse. Es decir, unos serán más resistentes que otros a reaccionar frente a un mismo medio. Ejemplo de esto son el oro y el hierro en agua dulce. El primer metal posee una alta inmunidad frente al agua, conservando inalteradas todas sus propiedades físicas y químicas. En cambio el hierro se degrada y poco a poco se transforma en otro compuesto. El cuestionarnos el porqué de tal diferencia entre uno y otro metal, es regresar a los orígenes automáticos de los elementos químicos, es decir, a la estructura y composición atómica de los metales en sí.
Si recordamos un poco nuestras clases de química elemental, nos daremos cuenta que un elemento químico cualquiera, como cada uno de los metales, está constituido por átomos idénticos y únicos en el Universo. Cada átomo está formado de un núcleo conteniendo partículas elementales como los protones y los neutrones. Rodeando a este núcleo se encuentran los electrones, unidades elementales de carga eléctrica negativa que forman una nube que envuelve al núcleo atómico. Los electrones en un átomo ocupan niveles energéticos específicos y de diverso orden. Es decir, de acuerdo a la posición de un electrón en el átomo, aquél poseerá mayor o menor energía. Dependiendo de la complejidad del átomo, esto es, del número de electrones, las capas y orbitales se irán llenando de éstos en diversos niveles y por lo tanto sus energías serán diferentes de átomo a átomo. Esta estructura está reflejada en el arreglo encontrado en la tabla periódica de los elementos.
Las energías de un átomo surgen pues de energías de correlación debidas principalmente a interacciones entre electrones afectando su campo electrostático. Esto es muy importante en la química de los elementos ya que las energías que se involucran están directamente relacionadas con las reactividades químicas o con las diferentes tendencias para cambiar de un estado libre, como en el caso de un metal, a un estado de ion metálico, en donde el átomo ha cedido uno o más electrones.
Para ilustrar esta diferencia, tomemos de la naturaleza el ejemplo de los llamados metales nobles tales como el oro y el platino, que se encuentran usualmente como metales libres en la tierra y no como compuestos. Por otro lado, existen los llamados metales activos o base tales como el sodio, aluminio y magnesio, los cuales jamás se podrán encontrar como metales libres en nuestra atmósfera terrestre, sino como compuestos. Existen ocasiones en que ciertos metales con actividades intermedias a los anteriormente citados, pueden encontrarse en la tierra como elementos libres. Ejemplo de tales metales son el cobre, la plata y el hierro.
Los metales más “nobles”, tales como el oro y el platino, son los menos “activos” y por tanto presentan la mayor resistencia a la corrosión. A estos metales se les refiere como metales relativamente catódicos. En cambio, los metales menos “nobles” como el caso del aluminio y el magnesio, son más “activos” y poseen una resistencia menor a la corrosión y se les conoce como metales que son relativamente anódicos.
Una reacción de corrosión puede expresarse parcialmente por la ionización de un metal, es decir, el proceso por el cual un átomo metálico pierde electrones y queda cargado con un exceso de cargas positivas (iguales a las cargas negativas de los electrones que se perdieron). Dicha entidad cargada constituye un ion positivo o catión. Así pues:
M → M+n + ne−
siendo M un metal de valencia n, M+n su forma iónica y e el número de electrones cedidos (figura 6).
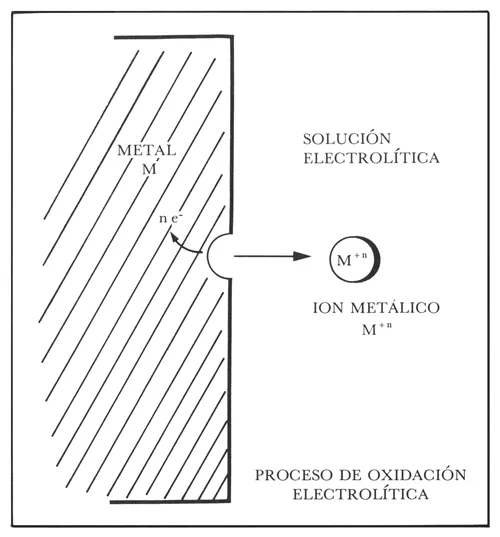
Figura 6.
Ahora bien, si nosotros deseamos conocer la posibilidad de que una reacción de corrosión ocurra espontáneamente bajo ciertas condiciones reales dadas, tendremos forzosamente que estudiar primeramente cuáles serían los cambios energéticos asociados con la reacción. Esto es, ver la magnitud de la energía que el metal poseía inicialmente antes de corroerse y luego ver la energía que poseen finalmente los productos de esa corrosión. Esto es precisamente a lo que se dedica la termodinámica de la corrosión. La termodinámica nos puede indicar una posibilidad de reacción, pero jamás nos dirá nada acerca de la velocidad con que se llevará a cabo, si es que la reacción es posible. Esto se decide por otros factores ajenos a la termodinámica, factores propios de lo que conocemos como cinética.
Con el fin de que la distinción entre la aplicación de la termodinámica y la cinética en un proceso de corrosión le quede al lector lo suficientemente claro, vamos a usar una analogía muy útil. Supongamos que una persona ha subido a lo alto de un tobogán y está a punto de deslizarse. Por su posición, esta persona posee una energía dada (energía potencial) para hacer un trabajo. Al deslizarse hacia abajo, su energía cambia, disipándose gradualmente; al llegar al suelo nuestra persona ha adquirido otra energía debido a su posición, la cual es un poco menor que la inicial, cuando se encontraba arriba. La diferencia entre ambas energías fue lo que propició la caída. Se dice pues que hubo un cambio de energía durante el proceso de bajada. Así también cuando hablamos de una reacción de corrosión, estamos hablando de la energía que el metal y otros reactivos tienen al inicio de la reacción y la energía que poseen los productos finales de tal reacción. Habrá también un cambio en energía del estado inicial y del estado final. La magnitud y signo de tal diferencia nos indicarán la mayor o menor tendencia a que el proceso ocurra. Para cualquier proceso, el cambio de energía se calcula de acuerdo a:
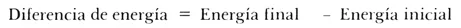
y para un proceso químico:

Cuanto mayor sea dicho cambio de energía, mayor será la tendencia a que el suceso ocurra. Si el signo del balance es negativo implica que se está pasando de un estado de mayor energía a otro de menor. A este tipo de proceso se le llama espontáneo y ocurre en la naturaleza por sí solo, disipando energía. Ejemplo, la caída de una piedra desde un puente, la degradación de hierro en un medio ácido, etc. Esto es lo que estudia la termodinámica, cambios de energía, tendencias a que el proceso ocurrra o no, sin decirnos nada acerca de la rapidez con que el proceso o la reacción se llevan a cabo.
La cinética nos da por otro lado los factores que afectan la velocidad del proceso. En el ejemplo del tobogán podemos decir que aun sabiendo que existía una probabilidad energética muy alta para que una persona dada resbalara desde la parte más alta hasta el piso, había factores que debían tomarse en cuenta para darnos una idea de cuán lento podría resultar el suceso. Por ejemplo, debimos considerar si el ángulo de deslizamiento del tobogán era adecuado o si estaba muy empinado o muy tendido, haciendo más fácil o más difícil el movimiento; también había que tomar en cuenta la superficie del tobogán, es decir, su rugosidad, la fricción causada entre el cuerpo que resbala y el canal del tobogán, la sinuosidad misma del camino a recorrer hacia abajo, etc. Hay muchos más factores que podríamos considerar que obstaculizaban o facilitaban el proceso mismo, haciéndolo más o menos difícil. Así pasa con la cinética de una reacción electroquímica como lo es el caso de la corrosión, en donde siempre habrá una dificultad dada a vencer para que el proceso ocurra, a pesar de que la termodinámica nos diga que la reacción es espontánea y que ocurrirá desde un punto de vista energético.
CELDAS GALVÁNICAS
Cuando dos metales diferentes, que tienen, por lo tanto reactividades diferentes, son sumergidos en una misma solución conductora, a la cual llamamos electrolito, y son conectados eléctricamente entre sí, tendremos un flujo de electrones del metal más activo o anódico hacia el metal más noble o catódico, dejando al material anódico con una deficiencia de electrones (figura 7). Esto trae como consecuencia que el metal más activo o ánodo se disuelva, es decir, se corroa.
El lector recordará del capítulo anterior que a este sistema se le denomina una pila de corrosión, la cual está caracterizada por tener los componentes básicos para que un proceso de corrosión ocurra, que son: dos fases eléctricamente conductoras (el hierro y el cobre), un medio acuoso en donde existan iones conductores de la corriente eléctrica (la solución de cloruro de sodio) y, para cerrar el circuito, un conductor eléctrico que una a las dos fases conductoras (el alambre de cobre). Es bien sabido que si uno de estos componentes falla, la corrosión no tendrá lugar. La corrosión ocurre en lo fundamental como se ha descrito anteriormente: una reacción electroquímica (porque hay flujo de electrones y también transformaciones químicas) que se lleva a cabo simultáneamente en zonas catódicas y anódicas.
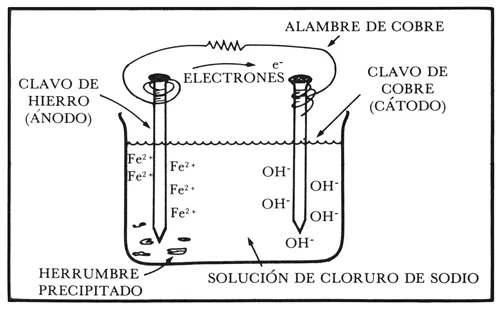
Figura 7.
Dejemos que la mente nos ayude a construir una imagen de lo que realmente sucede a nivel atómico durante un proceso de corrosión. Vayamos a la zona anódica de la reacción, es decir, a la zona en donde el hierro se está destruyendo gradualmente (figuras 7 y 8a).
En ese lugar el material anódico (el hierro) cede electrones al circuito eléctrico externo (alambre de cobre) debido a la diferencia de potencial creado por el par hierro cobre. Como habíamos explicado anteriormente, cada metal (hierro y cobre) posee una estructura atómica diferente y, como consecuencia de ello, una reactividad eléctrica local a través de la interfase entre el metal y el medio que lo rodea. Al entrar en contacto el hierro y el cobre se crea pues una diferencia de potencial eléctrico entre los dos metales, que hace que se mueva un flujo de electrones entre ellos.
Las partículas metálicas sobre la superficie del clavo de hierro (que en un principio eran neutras) ceden electrones y se convienen en átomos cargados positivamente (iones Fe2+) los cuales al interaccionar con las moléculas de agua pasan a la solución como especies solubles hidratadas. Reacciones químicas posteriores harán que estos iones Fe2+ se transformen en el óxido rojizo o herrumbe, tan familiar para nosotros.
Pero ¿qué ocurre con los electrones cedidos por los átomos de hierro que pasan la disolución?, ¿hacia dónde van a parar? Anteriormente ya habíamos planteado esta pregunta y vimos que la respuesta era simple. Debido a la diferencia de potencial creada, los electrones viajan a lo largo del circuito conductor externo hacia el cátodo (el clavo de cobre, figuras 7, 8b). Ahí, los electrones en exceso, presentes sobre la superficie catódica, se combinan con otras especies en solución con el fin de balancear la reacción química de corrosión. El oxígeno del aire disuelto en la solución es una de las especies que tienen afinidad por los electrones y que en combinación con el agua se transforma en especies oxhidrilo (OH−). Así pues, el metal anódico se desintegra, mientras que el material catódico, el clavo de cobre en el ejemplo, permanece casi sin ser afectado.
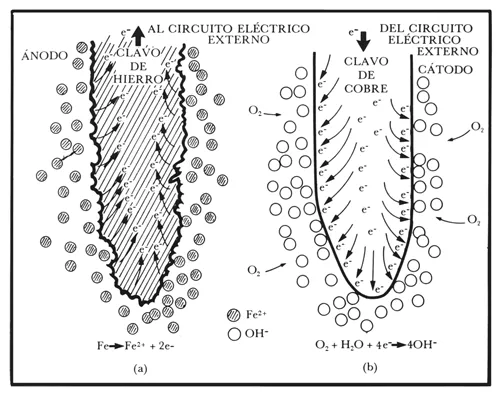
Figura 8.
Debe quedar claro que un proceso de corrosión involucra tanto la reacción anódica como la catódica, y que si una de las dos reacciones falla, el proceso de corrosión se detiene.
A la actividad electroquímica de esta naturaleza se le conoce como acción galvánica, base de cualquier reacción de corrosión. La acción galvánica constituye también el principio de las llamadas pilas “secas” que todos conocemos. El lector empieza a sospechar que un metal que se corroe es análogo...
Índice
- PORTADA
- ÍNDICE
- PRESENTACIÓN
- INTRODUCCIÓN
- I. La corrosión en la vida diaria
- II. ¿Por qué existe la corrosión?
- III. La física y la química de la corrosión. La corrosión metálica como ciencia aplicada
- IV. ¿Se puede medir la corrosión?
- V. ¿Se puede luchar contra la corrosión? El control de la corrosión