![]()
1 ESTRUCTURA ATÓMICA
Guía de estudio
Introducción
Composición del átomo
• Corteza electrónica y núcleo
- Propiedades
- Número másico
• Estructura de la corteza electrónica
- Órbitas y orbitales
- Energías del electrón ligado
- Estados fundamental y excitados
Masa y energía. Unidades
• Unidad de masa atómica
• Electronvolt
Nomenclatura nuclear
• Núclidos: notación
• Isótopos
Fuerzas nucleares
1.1 INTRODUCCIÓN
Los rayos X siempre ejercen una acción ionizante sobre cualquier material biológico, por lo que su utilización entraña riesgos, derivados de las correspondientes interacciones generadas. Deberán tomarse, por ello, medidas de uso adecuadas para proteger de efectos contraproducentes e innecesarios al paciente, al profesional involucrado e incluso al público en general: la protección radiológica se centrará, precisamente, en la prevención de tales riesgos inherentes al empleo práctico de las radiaciones ionizantes, sea en la industria, la investigación científica, la medicina o, como vamos a considerar más específicamente, la odontología.
Ahora bien, puesto que la interacción de las radiaciones ionizantes con la materia, sea ésta inerte o biológica, siempre se produce a nivel de los átomos que la integran, este primer capítulo debe dedicarse a una revisión de los conceptos fundamentales de la estructura atómica.
1.2 COMPOSICIÓN DEL ÁTOMO
La materia no es continua, sino que está constituida por diminutas partículas, los átomos, o sus agrupaciones, las moléculas. El átomo es, pues, la menor partícula de sustancia que posee todas las propiedades químicas de un elemento químico dado y fue, en principio, considerado como partícula indivisible. Hasta que en el primer tercio del pasado siglo el conocimiento científico reveló su propia estructura interna compleja: la de un átomo nuclear.
Descubrimiento del núcleo y la estructura del átomo
A finales del siglo XIX, a través esencialmente de los estudios de Dalton, Proust y Avogadro, ya se había establecido una hipótesis atómica de la materia, constituida por unidades microscópicas indivisibles, los átomos. Pero en los albores del siglo XX el átomo en sí seguía siendo un territorio desconocido, sin ninguna idea o conocimiento acerca de su estructura básica.
Es en 1897 cuando Thompson, apenas dos años después del descubrimiento de los rayos X por Roentgen, demuestra que los rayos catódicos están formados por unidades elementales de carga, a las que denomina electrones: "pequeños corpúsculos materiales que poseen la unidad elemental de carga". Ello obliga a admitir que el átomo, como unidad indivisible de materia anteriormente hipotetizada, debe poseer cierta estructura interna: si existen electrones sueltos o libres, han de proceder de los átomos. Thompson elabora, por ello, un primer modelo del átomo integrado por una esfera de electrones embebidos en un fluido de materia positiva que compense la carga de aquéllos: una especie de 'plum-cake' (pudín de ciruelas) de electrones, uniformemente incrustados como pasas en la esfera de carga positiva del resto del átomo (Fig. 1.1).
Figura 1.1 Modelo atómico de Thompson.
Pero un año antes (1896) Becquerel, a fin de comprobar (por pésimo consejo de Poincaré, por otro lado un gran físico) si la fluorescencia estaba relacionada con los rayos X, exponía al sol minerales supuestamente fluorescentes y los colocaba luego sobre una placa fotográfica para ver si la impresionaban. Apareció nublado dos días en París y guardó en un cajón alguno de los minerales, junto a un lote de películas. Cuando fue a utilizarlas se sorprendió de que, sin haberles dado el sol en absoluto, las placas se habían ennegrecido. El mineral en cuestión era la pechblenda, una sal de uranio, y Becquerel había descubierto, de forma absolutamente fortuita, la radiactividad.
No fue hasta un par de años más tarde (1898) que los esposos Curie captaron la importancia del descubrimiento de Becquerel y, tras un exhaustivo estudio, lograron aislar el polonio (nombre dado en honor del país originario de Marie Curie, Polonia) y el radio. Demostraron así que la materia era capaz de emitir radiaciones ionizantes que no eran rayos X sino pequeños 'trocitos' de la misma, a los que se llamó partículas α, identificadas posteriormente como núcleos de helio. Ello obligó a plantearse por qué de esa especie de 'pudín' atómico siempre salían trocitos muy bien organizados: bien partículas α o bien electrones. El mismo Thomson modifica su modelo y acepta que el fluido atómico interelectrónico tampoco es algo homogéneo.
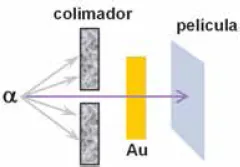
El descubrimiento de las partículas α llevó consigo la realización de multitud de experimentos, bombardeando con ellas blancos diversos. Y se hubo de esperar hasta 1911 cuando Rutherford, en unas experiencias de extraordinaria sofisticación, bombardea láminas de oro muy finas ('pan de oro') con un haz colimado de partículas α procedentes de un fuente de radio que, tras atravesar en su mayoría el oro, ionizándolo, impresionan una película: ¡¡las partículas α atravesaban la materia!! (Fig. 1.2). Pero su gran sorpresa todavía fue mayor cuando comprobó que la materia se evidenciaba 'casi vacía', ya que si el haz procedente del colimador llegaba a alcanzar justo el punto enfrentado, tras la lámina de oro, es que el oro no está 'lleno'. Además algunas partículas α (1 de cada 100.000) cambiaba de dirección incluso retrocediendo.
Figura 1.2 Experiencia de Rutherford.
¿Pero cómo puede una partícula α 'rebotar' hacia atrás, al decir de Rutherford "como si una bola de billar rebotara contra una bala de cañón"? Tenía que haber tropezado con algo tremendamente másico, por lo que hubo que admitir que la materia está prácticamente vacía y que toda la masa del átomo se encuentra concentrada en una especie de 'núcleo', con los electrones 'revoloteando' fuera de él y definiendo el tamaño del átomo: Rutherford descubre la existencia del núcleo atómico. ¿Y por qué situar fuera a los electrones? Ya se había estudiado que la materia se ioniza, al frotarla, por pérdida o ganancia de electrones; y para que tales electrones tengan esa facilidad de trasiego es por lo que Rutherford los ubica externamente, fuera del núcleo.
Rutherford llega además, a través de experiencias muy cuidadosas, a establecer el tamaño del núcleo: su diámetro es del orden de 10-14 a 10-15 m, es decir, más de 10.000 veces más pequeño que el de todo el átomo, de unos 10-10 m. En resumen, la masa de toda la materia está prácticamente concentrada en núcleos atómicos extraordinariamente pequeños.
Por su parte la corteza electrónica, que es la responsable de todas las propiedades químicas del átomo en sus interacciones, deberá poseer un número de electrones igual a su número atómico, Z, que determina la clasificación del elemento químico en la tabla periódica. Pero para que pueda existir electroneutralidad en el átomo, y por extensión en toda la materia no ionizada, el núcleo ha de poseer una carga positiva Z veces la carga del electrón. ¿Cómo justificarla y distribuirla?
Tras unos años científicamente especulativos y desorientados, el propio Rutherford (en colaboración con su discípulo Soddy) descubre en 1919 una nueva partícula que va a ser fundamental para la evolución en la concepción del núcleo: el protón. Lo hace al bombardear nitrógeno con partículas α produciendo núcleos de hidrógeno. De hecho Rutherford no sólo había tenido ya el honor de revelar la existencia del núcleo atómico (e incluso de clasificar las emisiones radiactivas), sino que también generaba la primera reacción nuclear conseguida artificialmente por el hombre. Admite, con buen acierto, que si se produce el núcleo del elemento más elemental, el del hidrógeno (el primero de la tabla) sin el electrón cortical, ese núcleo debe ser un componente primordial de toda la materia, al que por ello denomina protón. Su carga eléctrica es igual a la del electrón pero positiva y la espectrometría de masas también revela que su masa resulta muy superior, casi unas 2000 veces, a la del electrón, justificando que el núcleo posea la mayor parte de la masa del átomo.
Con los protones positivos en el núcleo, y los electrones negativos revoloteando en la corteza, ya fue posible abordar con más posibilidades la cuestión de la electroneutralidad de las átomos. Ahora bien, los primeros intentos al respecto resultaron bastante lamentables. La fácil solución de pensar en un átomo integrado por Z electrones en la corteza y Z protones en el núcleo no resulta factible, por cuanto que las masas atómicas resultan ser aproximadamente el doble de la correspondiente a los Z protones y los ligerísimos electrones apenas cuentan en los cómputos de masas. Los intentos...