![]()
Approfondimento 1.
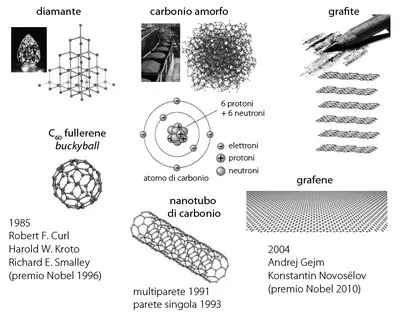
Stati allotropi del carbonio
Il carbonio non è l’unico materiale che assume «forme» diverse in base alla sua architettura microscopica. Molti elementi e composti, infatti, possono cristallizzare in modi diversi a seconda delle condizioni in cui avviene il processo. Le sostanze che presentano questa proprietà sono definite polimorfe e, nel caso siano composte da un solo elemento, si dice che presentano più forme allotropiche. Per esempio, l’ozono, la cui formula è O3, è un allotropo dell’ossigeno molecolare, O2.
Tuttavia, poiché il carbonio è la base della vita, vale la pena soffermarsi con particolare attenzione sulle diverse forme che può assumere (vedi figura 6), alcune delle quali hanno aperto negli ultimi anni interessanti prospettive alla ricerca scientifica.
Diamante
In un diamante, gli atomi sono disposti in una struttura tetraedrica e ogni atomo è legato con un legame covalente (un legame molto forte in cui sono messi in condivisione elettroni appartenenti ad atomi diversi) ad altri quattro, con i quali forma un angolo fisso (109,5°): è a causa di questa struttura tridimensionale particolarmente resistente che il diamante è il minerale più duro conosciuto dall’uomo, punto massimo della scala di Mohs, la quale misura la capacità di ogni sostanza di scalfire le altre. Ed è sempre questa disposizione a fare del diamante il miglior conduttore di calore che si conosca, fino a cinque volte migliore del rame.
Fig.6 – Stati allotropi del carbonio. (Immagine: S. Giordani, IIT)
Il diamante è anche molto denso e conduce bene il suono, ma non l’elettricità, non avendo elettroni sufficientemente delocalizzati perché si possano muovere in presenza di un campo elettrico; si tratta infatti di un isolante con notevoli proprietà di resistenza elettrica e altissima trasparenza ottica. Infine, il diamante è chimicamente inerte, cioè inattaccabile anche dagli acidi più energici, e biocompatibile (non è cioè dannoso per gli organismi viventi).
Grafite
Anche nella grafite gli atomi possono essere collegati gli uni agli altri in catene infinite, ma formano strati solo debolmente legati fra di loro: sui diversi «fogli», ogni atomo di carbonio ha legami molto forti (covalenti) con gli altri, disposti in una struttura esagonale simile a quella di una normale rete metallica; tra un foglio e l’altro, invece, i legami sono più deboli, di tipo van der Waals (la forza di van der Waals è una forza repulsiva alle piccole distanze ma attrattiva alle grandi, che dipende dalle interazioni fra dipoli, cioè sistemi costituiti da due cariche opposte).
I fogli risultano dunque «impilati», ed è facile separarli. È per questo che la grafite, a differenza del diamante, è morbida e si spacca con facilità, tanto che sulla scala di Mohs le corrisponde un valore minore di 1. La struttura planare degli strati consente inoltre agli elettroni di muoversi facilmente, e questo si traduce nelle buone qualità di conducibilità elettrica, oltre che termica, del materiale. Il colore è nero perché la grafite assorbe la luce visibile, a differenza del diamante, con il quale condivide invece la stabilità chimica, a freddo e a caldo.
Fullereni
I fullereni sono stati scoperti solo nel 1985 da un team di ricercatori della Rice University e della University of Sussex, tra i quali Harold Kroto, Robert Curl e Richard Smalley, insigniti nel 1996 del premio Nobel per la Chimica. Questi allotropi molecolari del carbonio prendono il nome da Richard Buckminster Fuller, l’architetto futurista inventore delle cupole geodetiche, che hanno una forma molto simile a queste molecole. Proprio per la loro forma sferica o sfericoidale, e come ulteriore omaggio a Fuller, che amava farsi chiamare Bucky, i fullereni sono anche chiamati buckyballs.
Le più piccole tra queste molecole sono i cosiddetti buckminsterfullereni (ne abbiamo accennato nell’Introduzione), la cui formula molecolare è C60, perché sono formati da sessanta atomi di carbonio disposti come i vertici di un icoesaedro troncato, ovvero di un solido formato da venti esagoni e dodici pentagoni, come un tipico pallone da calcio. Esistono anche fullereni composti da un numero maggiore di atomi di carbonio, e dunque più grandi (C70, C76, C78, C80, C84, fino a C960 e oltre).
Negli anni sono stati creati fullereni all’interno di altri fullereni, fullereni che contengono atomi di azoto o elio, e molecole formate da fullereni e altri gruppi chimici. Si sono così originati composti dalle notevoli proprietà ottiche, fotovoltaiche e biologiche: è il caso, per esempio, degli inibitori dell’HIV proteasi, che interferiscono con la maturazione e la replicazione del virus.
Nanotubi e grafene
Di ancora più vasto interesse applicativo è un altro allotropo del carbonio: il nanotubo, un fullerene di forma cilindrica, in alcuni casi chiamato anche buckytube.
Invece che da un miscuglio di esagoni e pentagoni, è costituito da soli esagoni e può essere anche molto lungo rispetto al suo spessore: come il nome suggerisce, il nanotubo ha un diametro di pochi nanometri (oltre diecimila volte più piccolo di quello di un capello), ma può essere lungo anche diversi centimetri. Si può ottenere a partire da buckminsterfullereni ai quali viene «tagliata» una porzione e aggiunta una stringa di diversi atomi di carbonio, seguita da altre stringhe fino a formare un tubicino che di solito ha almeno un estremo di forma arrotondata. Il modo in cui vengono aggiunte le stringhe di atomi può portare a tubi di struttura diversa: a zig-zag, a poltrona, o di forma chirale.
In generale, i nanotubi sono conduttori di calore piuttosto efficienti, come il diamante, e a seconda della forma hanno particolari proprietà elettriche e meccaniche. Pertanto, potrebbero avere molte applicazioni in nanoelettronica e ottica: se una lieve modifica nella struttura può cambiarne le caratteristiche fisiche, infatti, i nanotubi possono passare dall’assomigliare ai metalli, con la conduttività elettrica tipica per esempio del rame, al comportarsi come semiconduttori, assumendo la capacità di emettere luce a diverse lunghezze d’onda.
Se si «srotola» un nanotubo, si ottiene l’ultimo e più studiato tra i materiali allotropi del carbonio: il grafene, un foglio bidimensionale di atomi sempre disposti secondo uno schema esagonale molto regolare, che presenta particolarissime caratteristiche elettriche, termiche e fisiche. Si tratta del materiale più sottile conosciuto dall’uomo (dello spessore di un atomo), del più leggero (2630 m2 pesano 1 g), del più resistente (tra 100 e 300 volte più dell’acciaio), nonché del miglior conduttore di calore a temperatura ambiente e del migliore conduttore di elettricità.
![]()
PRIMA PARTE
Il piccolo mondo
![]()
1. Un po’ di storia
Chiunque non sia scioccato dalla meccanica quantistica non l’ha compresa.
NIELS BOHR
Immaginate un bambino che vi corre incontro per saltarvi in braccio. Non potrà pesare più di 15 kg, né correre più veloce di 10 km/h. Quando salta, lo afferrate al volo, lo sollevate tra le braccia, forse riuscite perfino a lanciarlo in aria e a riprenderlo subito dopo.
Ora sostituite il bambino con un toro di 1000 kg.
Nessuna persona sana di mente cercherebbe mai di prendere al volo un toro in corsa, perché il senso comune di cui tutti siamo dotati ci suggerisce che sarebbe una pessima idea. Le conseguenze sarebbero disastrose. Pochi, però, hanno familiarità con la meccanica newtoniana, e in particolare con la legge fisica che sottostà agli urti, e ancora meno sanno che queste regole, valide per uomini, tori, automobili, aeroplani, non valgono nel mondo dell’infinitamente piccolo.
Il momento in cui la comunità scientifica se ne accorse, all’alba del XX secolo, segna l’avvio della nostra storia.
La rivoluzione della meccanica quantistica
Se ciascuno di noi, come ricorda Melvyn Bragg in un bellissimo saggio, è come un nano che vive per qualche decina d’anni sulle spalle del gigante-umanità, incrementando la consapevolezza sviluppata nel corso dei millenni dai nostri predecessori, esistono – per riprendere la celebre distinzione di Enrico Fermi – scienziati che fanno del loro meglio per innovare e produrre sapere, scienziati che contribuiscono in modo fondamentale alla conoscenza umana, e infine geni che con le loro scoperte fanno fare passi in avanti all’umanità intera. Dall’Età della pietra a oggi, questi individui hanno cambiato il corso della storia e rivoluzionato il mondo.
Per nostra fortuna, atomi e molecole sono concetti relativamente giovani e non occorre risalire a lontane ere geologiche per raccontarne le vicende. Il passo è molto più breve, anche se questo non significa che sarà semplice.
La quantizzazione dell’energia e l’interazione fra radiazione e materia
La fine del XIX secolo e l’inizio del XX. Le macchine a vapore sono entrate nelle fabbriche, l’energia è ormai indispensabile per l’industria, le comunicazioni sono motore di scambio, i materiali evolvono con rapidità frastornante. Sono anni di dubbi, tribolazioni e diatribe scientifiche, anni in cui le informazioni non viaggiano attraverso internet, ma in treno o in nave, impiegando settimane se non mesi prima di giungere a destinazione. Un manipolo di scienziati (Ampère, Laplace, Faraday, Henry, Maxwell, in una prima fase; Ehrenfest, Schrödinger, de Broglie, Heisenberg, Lorentz, Einstein, Bohr, Born, Solvay, Poincaré, Langevin, Curie, Planck, in seguito) affronta in modo talvolta disordinato, ma senza dubbio visionario, una serie di problemi assolutamente nuovi: che cos’è la luce? Come interagisce con la materia? E che cos’è la materia? E l’energia? Qual è la relazione tra lo spazio e il tempo?
Non si tratta di domande meramente filosofiche. Tutt’altro. A quell’epoca, la scienza viveva ancora sulle solide basi poste dalla meccanica newtoniana e dalla più recente termodinamica, cioè la branca della fisica che studia i processi di scambio e di conversione del calore. Alla fine dell’Ottocento, però, l’affinamento della tecnologia e degli strumenti rese possibili esperimenti sempre più avanzati con le cariche elettriche e con la luce, e a lasciare perplessi erano i risultati, che spesso sembravano in disaccordo con le leggi di Newton sulla meccanica dei corpi, secondo le quali un corpo che si muove con velocità costante senza essere soggetto ad alcun tipo di forza esterna permane indefinitamente nel suo stato di moto rettilineo uniforme (principio di inerzia), ma se ne urta elasticamente un altro (dunque senza ammaccarsi o rompersi), scambia con esso energia e quantità di moto, in modo tale che l’energia e la quantità di moto complessive di entrambi i corpi siano conservate.
Perché queste osservazioni, verificate da secoli, sembravano non funzionare più? Si erano all’improvviso rivelate sbagliate? Ovviamente no: tutt’oggi, le robuste leggi della meccanica valgono per descrivere il movimento dei corpi «grandi». In quel periodo si cominciavano però a compiere esperimenti in cui gli oggetti studiati non erano più palline di legno, cubetti di metallo o comunque oggetti di dimensioni apprezzabili, bensì oggetti piccolissimi, non visibili a occhio nudo, come le cariche elettriche, che oggi chiamiamo elettroni, e la luce.
Il merito di questo spostamento, come abbiamo accennato, era delle tecnologie, protagoniste di un affinamento progressivo e costante: più la tecnica migliorava, più gli esperimenti diventavano sofisticati, più i risultati si facevano complessi. Dopotutto erano passati diversi secoli dalla mela di Newton, o dalle pur fantas...