
eBook - ePub
Lehrbuch der Zahntechnik
Band 3: Werkstofftechnik
Arnold Hohmann,Werner Hielscher
This is a test
- 480 pages
- German
- ePUB (mobile friendly)
- Available on iOS & Android
eBook - ePub
Lehrbuch der Zahntechnik
Band 3: Werkstofftechnik
Arnold Hohmann,Werner Hielscher
Book details
Book preview
Table of contents
Citations
About This Book
Das "Lehrbuch der Zahntechnik" von Hohmann/Hielscher gilt als Standardwerk für die Ausbildung an Berufs- und Meisterschulen. Die beiden Fachlehrer für Zahntechnik haben nun, nach lebenslanger Erfahrung im pädagogischen Dienst und im Zuge der Entwicklungen im zahntechnischen Bereich, ihr dreibändiges Werk nochmals überarbeitet.Die neue Auflage präsentiert sich mit vollständig überarbeiteten und erweiterten Inhalten und im neuen Design. Durchgängig anschaulich gestaltet und farbig illustriert ist der Klassiker eine wesentliche Grundlage für die zahntechnische Ausbildung in Schule und Labor.
Frequently asked questions
How do I cancel my subscription?
Can/how do I download books?
At the moment all of our mobile-responsive ePub books are available to download via the app. Most of our PDFs are also available to download and we're working on making the final remaining ones downloadable now. Learn more here.
What is the difference between the pricing plans?
Both plans give you full access to the library and all of Perlego’s features. The only differences are the price and subscription period: With the annual plan you’ll save around 30% compared to 12 months on the monthly plan.
What is Perlego?
We are an online textbook subscription service, where you can get access to an entire online library for less than the price of a single book per month. With over 1 million books across 1000+ topics, we’ve got you covered! Learn more here.
Do you support text-to-speech?
Look out for the read-aloud symbol on your next book to see if you can listen to it. The read-aloud tool reads text aloud for you, highlighting the text as it is being read. You can pause it, speed it up and slow it down. Learn more here.
Is Lehrbuch der Zahntechnik an online PDF/ePUB?
Yes, you can access Lehrbuch der Zahntechnik by Arnold Hohmann,Werner Hielscher in PDF and/or ePUB format, as well as other popular books in Medicine & Dentistry. We have over one million books available in our catalogue for you to explore.
Information
Metalle
Metalle werden in Bezug auf ihre chemischen und physikalischen Eigenschaften definiert. Alle Metalle haben in fester und flüssiger Form eine Anzahl physikalischer Eigenschaften, die man „metallischen Zustand“ nennt. Dieser Zustand liegt nicht mehr vor, wenn Metalle verdampfen. Aufgrund ihrer Stellung im Periodensystem weisen Metalle vergleichbare Merkmale auf, die allgemein zusammengefasst werden können; Metalle sind:
- bei Raumtemperatur fest (Ausnahme Quecksilber),
- plastisch formbar,
- metallisch glänzend,
- undurchsichtig, ohne Eigenfarbe,
- gute Wärmeleiter,
- gute Elektrizitätsleiter (Leiter 1. Klasse),
- miteinander mischbar, können Legierungen bilden,
- kristallin aufgebaut.
Metalle sind bestrebt, positive Ionen zu bilden, d. h., sie geben ihre Valenzelektronen ab. Metalle sind Elektronendonatoren (lat.; donator => Geber, Spender).
Als wichtigste physikalische Eigenschaften gelten die elektrische und gute thermische Leitfähigkeit, die Fähigkeit, bei hohen Temperaturen und unter Einfluss energiereicher Strahlung Elektronen zu emittieren (lat.; aussenden), der metallische Glanz, die leichte mechanische Verformbarkeit unter Druck und das Strukturprinzip des dichtgepackten Metallgitters, bei dem jedes Atom eine große Anzahl nächster Nachbaratome besitzt. 82 von den 104 bekannten Elementen sind Metalle, die die genannten Eigenschaften besitzen.
Elemente, die die meisten dieser Eigenschaften nicht besitzen, werden als Nichtmetalle bezeichnet. Diese sind bestrebt, bei chemischen Verbindungen Elektronen aufzunehmen. Nichtmetalle sind Elektronenakzeptoren (lat.; acceptor => Empfänger). Elemente, die weder den Metallen noch den Nichtmetallen zuzuordnen sind, werden Halbmetalle genannt.
Die Einteilung der Metalle erfolgt in Bezug auf die Eigenschaften; man unterscheidet bezogen auf die Dichte Leichtund Schwermetalle, bezogen auf die chemische Reaktionsfähigkeit Edel- und Nichtedelmetalle, sowie bezogen auf den Schmelzpunkt niedrig- und hochschmelzende Metalle. Metalle sind nur in geringer Menge in der Erdrinde enthalten (Ausnahme: Aluminium, Eisen, Magnesium); Edelmetalle mit weniger als einem Gramm pro Tonne Eruptivgestein. Gold und Platin kommen mit den Beimetallen Palladium, Rhodium, Iridium, Ruthenium und Osmium in gediegener Form vor; seltener auch Silber, Kupfer und Quecksilber. Die Metallgewinnung erfolgt durch hochmetallhaltige Mineralien oder Mineralgemenge (Erze), die Sulfide (Schwefelverbindungen), Oxide (Sauerstoffverbindungen) oder Salze der Metalle enthalten.
Die spezifische Form der chemischen Bindung der Atome von Metallen und Legierungen offenbart sich in der Bildung eines Metallgitters. Die Metallatome haben die Neigung, ihre Valenzelektronen abzugeben und positiv geladene Atomrümpfe zu bilden, die sich in einem ganz regelmäßigen Raumgitter zusammenschließen.
Die Gitterpunkte sind durch die Atomrümpfe besetzt, wobei jedes Atom (im kubisch-raumzentrierten Gitter) 8 nächste Nachbarn und noch 6 zusätzliche, geringfügig weiter entfernte Nachbarn hat. Durch diese große Anzahl der von einem Atom ausgehenden Wechselwirkungen mit den Nachbaratomen wird die gesamte Bindungsenergie in einem Metallgitterteilstück (Kristall) gegenüber einem Molekül praktisch verdoppelt (26 kcal/mol).
Der Begriff Atomrumpf anstatt der Bezeichnung Ion steht hier deswegen, weil zwei Vorstellungen über die metallische Bindung darin vereint sind: Zum einen geht man davon aus, dass die Metallatome Valenzelektronen abgeben und dadurch zu elektrisch geladenen Teilchen, zu Ionen, werden. Zum anderen wird mit dem Begriff Ion das entscheidende Merkmal der Beweglichkeit des Teilchens in einem elektrischen Feld verbunden (Ion = wandernd, griech.). Die Metallatome sind aber auf den Gitterpunkten fixiert, also nicht frei beweglich.
Wenn die Atomrümpfe positiv geladen sind, müss-ten sie sich gegenseitig abstoßen, oder allgemeiner gefragt: Wieso bilden Elemente Verbindungen mit sich selbst, obgleich die Anzahl der Außenelektronen nicht ausreicht, für jedes an der Verbindung beteiligte Atom eine stabile Edelgaskonfiguration zu erreichen? Hierzu sollen zwei Erklärungsmodelle erläutert werden. Zunächst wird das Bindekräftegleichgewicht vorgestellt, um das grundlegende Verständnis für die metallische Bindung zu eröffnen. Danach folgt das Energiebändermodell, woraus sich einige typische gemeinsame Eigenschaften der Metalle ableiten lassen.

Abb. 469 Einteilung der Metalle bezogen auf ihre Eigenschaften

Abb. 470 Bei der regelmäßigen, dreidimensionalen Anordnung der Metallatome entsteht ein Raumgitter mit einer Kugelpackung unterschiedlicher Raumfüllungsdichte und Verformbarkeit. Die Gitterpunkte sind durch die Atomrümpfe besetzt. Das Raumgitter lässt sich auf eine kleinste Einheit reduzieren, die als Elementarzelle bezeichnet wird. Der Abstand der Atome auf den Gitterpunkten dieser Elementarzelle wird als Gitterkonstante bezeichnet. Jedes Atom steht mit seinen Nachbaratomen in einer Wechselwirkung, die die gesamte Bindungsenergie in einem Metallgitterteilstück bestimmt.
Metallbindung
Die metallische Bindung kann erklärt werden mit einer elektrostatischen Wechselwirkung zwischen den Atomrümpfen einerseits und durch die negative Ladungsdichte sämtlicher Valenzelektronen andererseits, wodurch alle positiv geladenen Atomrümpfe in einem elektrisch geladenen Feld mit negativer Ladungsverteilung hoher Dichte eingebettet sind. Die Bindungskräfte der Elektronen wirken auf alle benachbarten Atomrümpfe gleichermaßen und so entsteht das Vorstellungsbild eines „Riesenmoleküls“ in Form eines Kristalls, bei dem die bindenden Elektronen so beweglich und labil sind, dass sie schon in einem schwachen elektrischen Feld wandern und den elektrischen Strom leiten.
Die Bindungsenergie zwischen zwei einzelnen Metallatomen ist wesentlich geringer als die gerichteten Kräfte in der Atombindung, dennoch erreichen die Metallatome einen recht stabilen und energiearmen Zustand. Dadurch ist die Bindungsenergie in einem Gesamtkristall höher als in einem Molekül mit Atombindung. Wegen der geringeren Einzelbindungsenergie haben die Metalle geringere Schmelztemperaturen als die diamantartigen Stoffe, abgesehen von Wolfram (3410 °C), Rhenium (3180 °C) und Molybdän (2620 °C).
Die elektrostatische Wechselwirkung der Atomrümpfe untereinander muss nun noch genauer untersucht werden, denn es ist ja nicht unmittelbar einleuchtend, wie die freien Valenzelektronen mit ihrer negativen Ladungsverteilung eine Bindung zum Kristallgitter entgegen den Abstoßungskräften der positiven Atomrümpfe bewirken sollen. Die Ladungsstärke zwischen den Valenzelektronen und dem Ladungsüberschuss der Atomrümpfe ist ausgeglichen; anders gesagt: Es besteht keine Ladungsdifferenz zwischen Elektronenladung und Kernladung. Dennoch befinden sich die Atomrümpfe durch die negative Ladungsverteilung der Valenzelektronen im Zustand negativer potentieller Energie, die für die tatsächlichen Kernabstände ein Minimum besitzt, so dass eine Bindung mit typischen Kristallgittern möglich wird.
Atomrümpfe sind nach außen elektrisch positiv geladen, und dieser Ladungsüberschuss wirkt auf die Elektronenhülle der jeweiligen Nachbaratome und umgekehrt, denn die Atomhülle liegt dem jeweiligen Atom ja näher als der positive Atomkern des Nachbarn. Zu dieser relativ schwachen Wechselwirkung kommt die Bindekraft der Valenzelektronen hinzu. Daneben wirkt eine Massenanziehung zwischen den Atomrümpfen, die abhängig ist vom Abstand der Kerne zueinander. Die Massenanziehung gehört zu den starken Wechselwirkungen, deren Wesen nicht genau bestimmt ist.
Die elektrostatischen Wechselwirkungen aus Ladungsdichte der Valenzelektronen, aus der Anziehung der Elektronenhülle der Nachbaratome und der Massenanziehung einerseits und die Abstoßung der positiven Kerne andererseits lässt sich in einem Diagramm darstellen. Die Summe der Wechselwirkungen weist einen Zustand aus, in dem abstoßende und anziehende Kräfte im Gleichgewicht sind, nämlich dort, wo die Resultierende im Diagramm die Ordinate schneidet.
Der Nulldurchgang stellt den Abstand der Atome im Metallgitter dar; hier halten sich die abstoßenden und anziehenden Kräfte die Waage. Wird der Atomabstand vergrößert, treten anziehende Kräfte auf. Wird im Gegenteil der Atomabstand verringert, wirken plötzlich abstoßende Kräfte, die umso größer werden, je geringer der Abstand wird. Im Metallgitter werden die Atome also einen festen Abstand zueinander einnehmen, der dieser Gleichgewichtslage entspricht, und das führt, weil alle Atome diesen festen Abstand einhalten müssen, zu einem ganz regelmäßigen räumlichen Kristallgitter. Die Atomrümpfe werden im Allgemeinen Schwingungen um diese Gleichgewichtslagen, die Gitterpunkte, durchführen.
Durch thermische Anregung (Energiezufuhr) können diese Schwingungen vergrößert werden, wodurch die Atome einen größeren durchschnittlichen Abstand voneinander einnehmen müssen und das Gitter sich aufweiten wird. Im Makroskopischen nimmt das Volumen des Metalls zu, was mit dem Begriff der thermischen Expansion (Wärmeausdehnung) beschrieben ist. Bei weiterer Wärmezufuhr werden die Schwingungen der Atome immer größer, bis sie sich aus dem Metallgitter lösen und das Gitter zusammenbricht; das Metall schmilzt. Die Schmelztemperatur steigt in der Regel mit zunehmender Anzahl an Valenzelektronen und mit geringerem Abstand der Atome im Gitter (Gitterkonstante).
Damit ist ein triviales Erklärungsmodell für die metallische Bindung geboten und gleichzeitig sind damit schon einige typische Eigenschaften der Metalle erläutert worden.
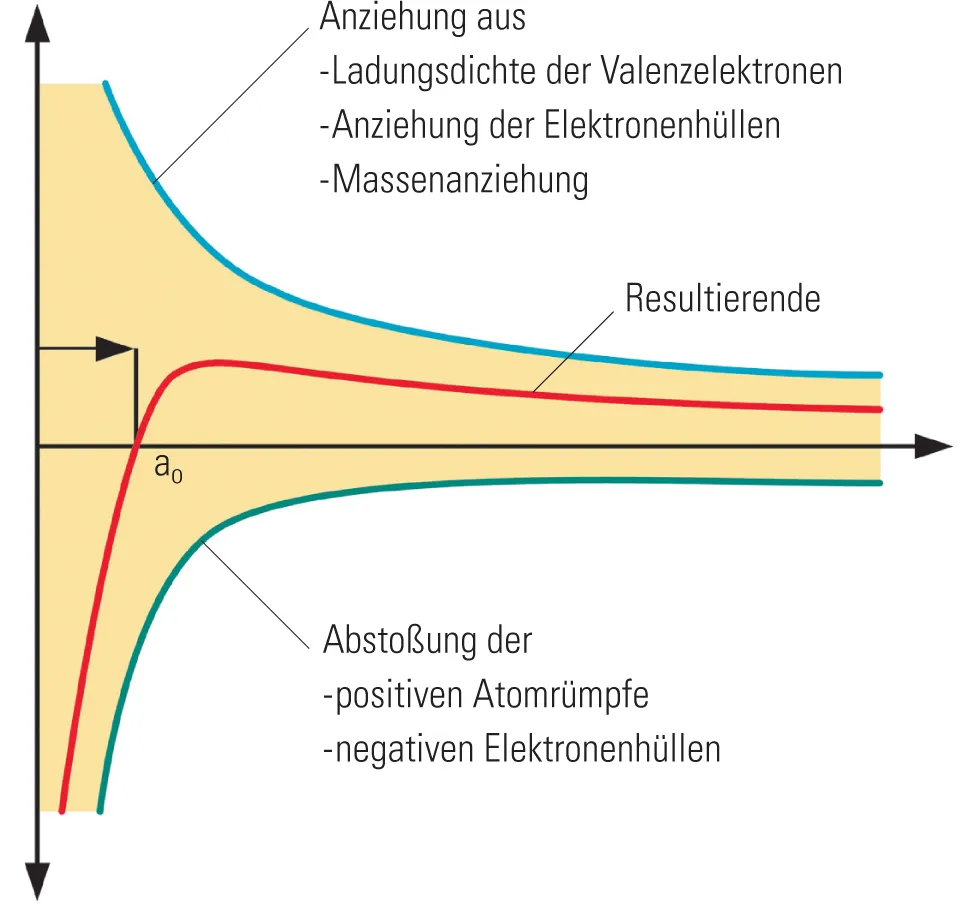
Abb. 471 In einen Diagramm lassen sich die elektrostatischen Wechselwirkungen aus Ladungsdichte der Vale...
Table of contents
- Cover
- Titelseite
- Impressum
- Inhalt
- Vorwort
- Zahntechnischer Arbeitsbereich
- Universalien der Werkstoffkunde
- Hilfswerkstoffe
- Fertigungsverfahren
- Kunststoffe
- Metalle
- Dentalkeramik
- CAD/CAM-Technik
- Literaturverzeichnis
Citation styles for Lehrbuch der Zahntechnik
APA 6 Citation
Hohmann, A., & Hielscher, W. (2019). Lehrbuch der Zahntechnik (5th ed.). Quintessence Publishing. Retrieved from https://www.perlego.com/book/1438301/lehrbuch-der-zahntechnik-band-3-werkstofftechnik-pdf (Original work published 2019)
Chicago Citation
Hohmann, Arnold, and Werner Hielscher. (2019) 2019. Lehrbuch Der Zahntechnik. 5th ed. Quintessence Publishing. https://www.perlego.com/book/1438301/lehrbuch-der-zahntechnik-band-3-werkstofftechnik-pdf.
Harvard Citation
Hohmann, A. and Hielscher, W. (2019) Lehrbuch der Zahntechnik. 5th edn. Quintessence Publishing. Available at: https://www.perlego.com/book/1438301/lehrbuch-der-zahntechnik-band-3-werkstofftechnik-pdf (Accessed: 14 October 2022).
MLA 7 Citation
Hohmann, Arnold, and Werner Hielscher. Lehrbuch Der Zahntechnik. 5th ed. Quintessence Publishing, 2019. Web. 14 Oct. 2022.